题目内容
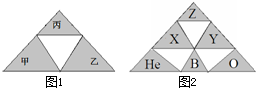
A、B、C、D、E为五种短周期元素,其中A、B、C三元素在元素周期表中的位置如图所示,已知B原子核内质子数和中子数相等,A、B、C三种元素的原子核外电子数之和等于B的质量数,B、D、E属于同一周期,D元素原子的最外层只有一个电子,E元素的质子数比D元素的质子数多两个.回答下列问题:
(1)写出B、E的元素符号:B______、E______.
(2)A、B、C、D、E的单质中,氧化性最强的化学式为______,B、C气态氢化物的热稳定性的顺序为______.
(3)A的氢化物溶于水呈______性,该氢化物与A的最高价氧化物对应的水化物反应生成的盐中,所含化学键为______.
(4)写出D和E的最高价氧化物对应的水化物二者反应的离子方程式______.
| A | C | |
| B |
(2)A、B、C、D、E的单质中,氧化性最强的化学式为______,B、C气态氢化物的热稳定性的顺序为______.
(3)A的氢化物溶于水呈______性,该氢化物与A的最高价氧化物对应的水化物反应生成的盐中,所含化学键为______.
(4)写出D和E的最高价氧化物对应的水化物二者反应的离子方程式______.
由元素在短周期的位置可知,A、C处于第二周期,B处于第三周期.B、D、E属于同一周期,D元素原子的最外层只有一个电子,则D为Na元素;E元素的质子数比D元素的质子数多两个,则E为Al元素;B原子核内质子数和中子数相等,A、B、C三种元素的原子核外电子数之和等于B的质量数,设B元素的质子数为x,则A的质子数为x-9,C的质子数为x-7,可得x-9+x-7+x=2x,解之得x=16,所以A的质子数为7,B的质子数为16,C的质子数为9,故A为氮元素、B为硫元素、C为氟元素,
(1)由上述分析可知,B为S,E为Al,
故答案为:S;Al;
(2)A、B、C、D、E的单质中,氟元素的非金属性最强,F2的氧化性最强;
非金属性F>S,故气态氢化物的热稳定性的顺序为HF>H2S,
故答案为:F2;HF>H2S;
(3)A的氢化物为NH3,溶于水呈碱性,氨气与硝酸反应生成硝酸铵,含有离子键、共价键,
故答案为:碱;离子键、共价键;
(4)氢氧化钠与氢氧化铝反应生成偏铝酸钠与水,反应离子方程式为:OH-+Al(OH)3═AlO2-+2H2O,
故答案为:OH-+Al(OH)3═AlO2-+2H2O.
(1)由上述分析可知,B为S,E为Al,
故答案为:S;Al;
(2)A、B、C、D、E的单质中,氟元素的非金属性最强,F2的氧化性最强;
非金属性F>S,故气态氢化物的热稳定性的顺序为HF>H2S,
故答案为:F2;HF>H2S;
(3)A的氢化物为NH3,溶于水呈碱性,氨气与硝酸反应生成硝酸铵,含有离子键、共价键,
故答案为:碱;离子键、共价键;
(4)氢氧化钠与氢氧化铝反应生成偏铝酸钠与水,反应离子方程式为:OH-+Al(OH)3═AlO2-+2H2O,
故答案为:OH-+Al(OH)3═AlO2-+2H2O.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案
相关题目
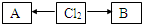 ,A、B中氯元素化合价的代数和为0,且均是共价化合物,A为强电解质,B具有漂白性,写出A→Cl2的化学反应方程式______;C与B的组成元素相同,C中氯元素的化合价为最高价,C与H2SO4相比,酸性强的是______(填化学式).
,A、B中氯元素化合价的代数和为0,且均是共价化合物,A为强电解质,B具有漂白性,写出A→Cl2的化学反应方程式______;C与B的组成元素相同,C中氯元素的化合价为最高价,C与H2SO4相比,酸性强的是______(填化学式).