题目内容
【题目】水的电离平衡曲线如图所示,下列说法不正确的是( )
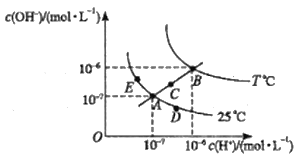
A.图中五点Kw间的关系B>C>A=D=E
B.若从A点到C点,可采用温度不变在水中加入适量的NH4Cl固体
C.若从A点到D点,可采用温度不变在水中加入少量的酸
D.若处在B点时,将pH=2的硫酸与pH=10的KOH溶液等体积混合后,溶液呈中性
【答案】B
【解析】
从图中可知,A点时,KW=10-7×10-7=1×10-14;B点时,KW=10-6×10-6=1×10-12。由于水的电离是一个吸热过程,所以温度A<C<B。
A.由以上分析可知,温度为B>C>A,则Kw为B>C>A,A、D、E三点的温度相同,Kw为A=D=E,所以图中五点Kw间的关系B>C>A=D=E,A正确;
B.在C点,c(H+)=c(OH-),温度不变在水中加入适量的NH4Cl固体,则溶液中c(H+)>c(OH-),B不正确;
C.A点与D点温度相同,D点c(H+)>c(OH-),可在A点的水中加入少量酸,C正确;
D.B点pH=10,c(OH-)=10-2mol/L,将pH=2的硫酸与pH=10的KOH溶液等体积混合后,二者刚好完全反应,溶液呈中性,D正确;
故选B。

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案
相关题目
【题目】50mL0.55mol/LNaOH溶液和50mL0.25mol/L硫酸溶液反应,测定中和热。近似认为两溶液的密度都是1g/cm3,实验数据如下表:
温度 实验次数 | 起始温度t1℃ | 终止温度t2℃ | ||
H2SO4 | NaOH | 平均值 | ||
1 | 26.2 | 26.0 | 26.1 | 29.5 |
2 | 27.0 | 27.4 | 27.2 | 32.3 |
3 | 25.9 | 25.9 | 25.9 | 29.2 |
4 | 26.4 | 26.2 | 26.3 | 29.8 |
中和后生成溶液的比热容c=4.18J/(g·℃),则中和热△H=___(取小数点后一位)