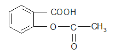题目内容
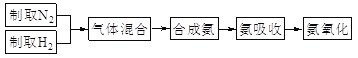
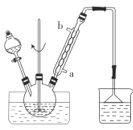
【题目】实验室模拟合成氨和氨催化氧化的流程如下:
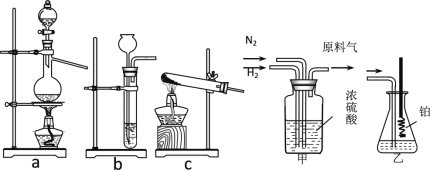
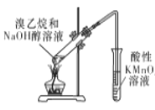
已知:实验室用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。
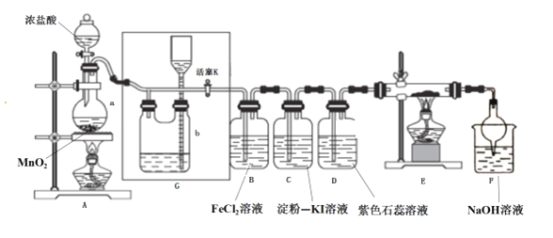
(1)从图中选择制取气体的合适装置:氮气__、氢气___。
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有__、_。
(3)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是:_,锥形瓶中还可观察到的现象是:____。
(4)写出乙装置中氨氧化的化学方程式:_____。
(5)反应结束后锥形瓶内的溶液中含有H+、OH-、_、_离子。
【答案】a b 干燥气体 控制氮气和氢气的流速 氨气的氧化反应是放热反应 有红棕色气体生成 4NH3+5O2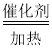 4NO+6H2O NH4+ NO3-
4NO+6H2O NH4+ NO3-
【解析】
(1)实验室用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气,用锌与稀硫酸制取氢气,不需要加热,故制取氮气选择装置a,制取氢气选择装置b;
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有干燥气体,控制氮气和氢气的流速;
(3)使铂丝保持红热的原因是:氨气的氧化反应是放热反应,装置乙的锥形瓶中发生的反应为4NH3+5O2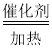 4NO+6H2O,生成的一氧化氮可被装置中的氧气氧化为二氧化氮,锥形瓶中还可观察到的现象是:有红棕色气体生成;
4NO+6H2O,生成的一氧化氮可被装置中的氧气氧化为二氧化氮,锥形瓶中还可观察到的现象是:有红棕色气体生成;
(4)由(3)分析可得,乙装置中氨氧化的化学方程式:4NH3+5O2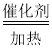 4NO+6H2O;
4NO+6H2O;
(5)乙装置中还发生的反应有NO2+H2O=2HNO3+NO,HNO3+ NH3= NH4NO3,反应结束后锥形瓶内的溶液中含有H+、OH-、NH4+、NO3-。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】50mL0.55mol/LNaOH溶液和50mL0.25mol/L硫酸溶液反应,测定中和热。近似认为两溶液的密度都是1g/cm3,实验数据如下表:
温度 实验次数 | 起始温度t1℃ | 终止温度t2℃ | ||
H2SO4 | NaOH | 平均值 | ||
1 | 26.2 | 26.0 | 26.1 | 29.5 |
2 | 27.0 | 27.4 | 27.2 | 32.3 |
3 | 25.9 | 25.9 | 25.9 | 29.2 |
4 | 26.4 | 26.2 | 26.3 | 29.8 |
中和后生成溶液的比热容c=4.18J/(g·℃),则中和热△H=___(取小数点后一位)
【题目】对硝基甲苯(![]() )是医药、染料等工业的一种重要有机中间体,一种制备对硝基甲苯的实验步骤如下:
)是医药、染料等工业的一种重要有机中间体,一种制备对硝基甲苯的实验步骤如下:
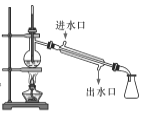
步骤1:向三颈烧瓶中加入甲苯(液态),以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),以CCl4为溶剂,乙酸酐为脱水剂(与水反应生成乙酸),45℃下搅拌、回流1h。实验装置如图所示(加热和仪器固定装置均已略去)。
步骤2反应结束后,过滤,滤液分别用5%NaHCO3溶液、水洗至中性。
步骤3:所得液体再经分离提纯得到对硝基甲苯。
(1)装置中,冷却水应从______________(填“a”或“b”)口通入。
(2)反应须控制在45℃下进行的原因是______________。
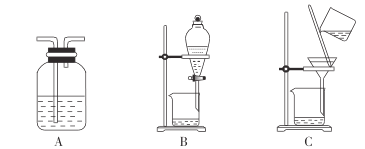
(3)步骤2中,过滤所得滤渣是______________(填化学式);对滤液进行洗涤可用下列装置中的______________(填字母)。
(4)表中所给出了催化剂种类及用量对甲苯硝化反应影响的实验结果。
催化剂 | n(催化剂) | 硝化产物中各种异构体质量分数(%) | 总产率(%) | ||
n(甲苯) | 对硝基甲苯 | 邻硝基甲苯 | 间硝基甲苯 | ||
浓H2SO4 | 1.0 | 35.6 | 60.2 | 4.2 | 98.0 |
1.2 | 36.5 | 59.5 | 4.0 | 99.8 | |
NaHSO4 | 0.15 | 44.6 | 55.l | 0.3 | 98.9 |
0.25 | 46.3 | 52.8 | 0.9 | 99.9 | |
0.32 | 47.9 | 51.8 | 0.3 | 99.9 | |
0.36 | 45.2 | 54.2 | 0.6 | 99.9 | |
已知:对硝基甲苯、邻硝基甲苯和间硝基甲苯的沸点分别为238.5℃、222℃和230.5℃。
①NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为______________,
②与浓硫酸作催化剂相比,NaHSO4作催化剂的优点有______________、______________。
③步骤3中,从三种异构体的混合物中分离出对硝基甲苯的方法为______________。