题目内容
新型锂离子电池在新能源的开发中占有重要地位。可用作节能环保电动汽车的动力电池。磷酸亚铁锂(LiFePO4)是新型锂离子电池的首选电极材料,它的制备方法如下:
方法一:将碳酸锂、乙酸亚铁[(CH3COO)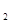 Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出。
Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出。
方法二:将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀。沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂。
在锂离子电池中,需要一种有机聚合物作为正负极之间锂离子迁移的介质,该有机聚合物的单体之一(用M表示)的结构简式如下: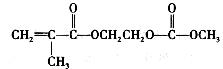
请回答下列问题:
(1)上述两种方法制备磷酸亚铁锂的过程都必须在惰性气体氛围中进行。其原因是 。
(2)在方法一所发生的反应中, 除生成磷酸亚铁锂、乙酸外, 还有 、 、 (填化学式)生成。
(3)在方法二中,阳极生成磷酸亚铁锂的电极反应式为 。
(4)写出M与足量氢氧化钠溶液反应的化学方程式: 。
(5)已知该锂离子电池在充电过程中,阳极的磷酸亚铁锂生成磷酸铁,则该电池放电时正极的电极反应式为 。
(1)防止亚铁化合物被氧化 (3分)
(2)CO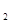 H
H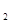 O NH3 (3分)
O NH3 (3分)
(3)Fe+H P
P +Li+
+Li+ 2e
2e =LiFePO4+2H+ (3分)
=LiFePO4+2H+ (3分)
(4)  (3分)
(3分)
(5)FePO4+Li++e =LiFePO4 (3分)
=LiFePO4 (3分)
解析试题分析:(1)亚铁离子具有强还原性,制备磷酸亚铁锂的过程都必须在惰性气体氛围中进行,其原因是为了防止亚铁化合物被氧化;(2)将碳酸锂、乙酸亚铁、磷酸二氢铵在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂、乙酸及其它产物均以气体逸出.根据题意和元素守恒,可得其他产物为:CO2、H2O和NH3;(3)将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀.阳极铁失电子生成磷酸亚铁锂,电极反应式为Fe+H2PO4-+Li+-2e-=LiFePO4+2H+;(4)M具有酯基,在碱性条件下可发生水解,M与足量氧化钠溶液反应的化学方程式: ,;(5)锂离子电池在充电过程中,阳极的磷酸亚铁锂生成磷酸铁,电极反应为LiFePO4═FePO4+Li++e-,该电池放电时,正极发生还原反应,与充电时的阳极反应相反,电极反应式为FePO4+Li++e-═LiFePO4。
,;(5)锂离子电池在充电过程中,阳极的磷酸亚铁锂生成磷酸铁,电极反应为LiFePO4═FePO4+Li++e-,该电池放电时,正极发生还原反应,与充电时的阳极反应相反,电极反应式为FePO4+Li++e-═LiFePO4。
考点:本题考查了原电池和电解质的工作原理,题目难度中等,本题注意原电池、电解池的两极反应,把握电极反应式的书写方法,为中学电化学常考查内容。

 计算高手系列答案
计算高手系列答案某蓄电池反应为NiO2+Fe+2H2O Fe(OH)2+Ni(OH)2。
Fe(OH)2+Ni(OH)2。
(1)该蓄电池充电时,发生还原反应的物质是 (填下列字母),放电时生成Fe(OH)2的质量18 g,则外电路中转移的电子数是 。
| A.NiO2 | B.Fe | C.Fe(OH)2 | D.Ni(OH)2 |
(3)以该蓄电池做电源,用右图所示装置,在实验室模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用相关的电极反应式和离子方程式表示)。 。

(4)精炼铜时,粗铜应与直流电源的 极(填“正”或“负”)相连,精炼过程中,电解质溶液中c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解,甲同学设计如下除杂方案:

已知:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀时的pH | 2.3 | 7.5 | 5.6 | 6.2 |
| 完全沉淀时的pH | 3.9 | 9.7 | 6.4 | 8.0 |
则加入H2O2的目的是 ,乙同学认为应将方案中的pH调节到8,你认为此观点 (填“正确”或“不正确”),理由是 。
为了探究原电池和电解池的工作原理,某研究性学习小组分别用下图所示的装置进行实验。据图回答问题。

I.用图甲所示装置进行第一组实验时:
(1)在保证电极反应不变的情况下,不能替代Cu作电极的是 (填序号)。
| A.石墨 | B.镁 | C.银 | D.铂 |
II.该小组同学用图乙所示装置进行第二组实验时发现,两极均有气体产生,且Y极溶液逐渐变成紫红色:停止实验观察到铁电极明显变细,电解液仍然澄清。查阅资料知,高铁酸根(FeO42-)在溶液中呈紫红色。请根据实验现象及所查信息,回答下列问题:
(3)电解过程中,X极溶液的pH (填“增大”“减小”或“不变”)
(4)电解过程中,Y极发生的电极反应为4OH?-4e?=2H2O+O2↑和 。
(5)电解进行一段时间后,若在X极收集到672mL气体,Y电极(铁电极)质量减小0.28g,则在Y极收集到气体为 mL(均已折算为标准状况时气体体积)。
(6)K2FeO4—Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电池反应为:
2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的电极反应式为 。
某研究性学习小组欲探究原电池的形成条件,按下图所示装置进行实验
| 序号 | A | B | 烧杯中的液体 | 指针是否偏转 |
| 1 | Zn | Cu | 稀硫酸 | 有 |
| 2 | Zn | Zn | 稀硫酸 | 无 |
| 3 | Cu | C | 氯化钠溶液 | 有 |
| 4 | Mg | Al | 氢氧化钠溶液 | 有 |
分析上述数据,回答下列问题:
(1)实验1中由A极流向B极的是 (填“电流”或“电子”);
(2)实验4中电子由B极流向A极,表明负极是 电极(填“镁”或“铝”);电极反应式为: ;
(3)实验3表明 (选填序号);
①铜在潮湿空气中不会被腐蚀 ②铜的腐蚀是自发进行的
(4)分析上表有关信息,下列说法不正确的是 (选填序号)。
①相对活泼的金属一定做负极
②失去电子的电极是负极
③烧杯中的液体,必须是电解质溶液
④浸入同一电解质溶液中的两个电极,是活泼性不同的二种金属(或其中一种能导电的非金属)







