题目内容
某研究性学习小组欲探究原电池的形成条件,按下图所示装置进行实验
| 序号 | A | B | 烧杯中的液体 | 指针是否偏转 |
| 1 | Zn | Cu | 稀硫酸 | 有 |
| 2 | Zn | Zn | 稀硫酸 | 无 |
| 3 | Cu | C | 氯化钠溶液 | 有 |
| 4 | Mg | Al | 氢氧化钠溶液 | 有 |
分析上述数据,回答下列问题:
(1)实验1中由A极流向B极的是 (填“电流”或“电子”);
(2)实验4中电子由B极流向A极,表明负极是 电极(填“镁”或“铝”);电极反应式为: ;
(3)实验3表明 (选填序号);
①铜在潮湿空气中不会被腐蚀 ②铜的腐蚀是自发进行的
(4)分析上表有关信息,下列说法不正确的是 (选填序号)。
①相对活泼的金属一定做负极
②失去电子的电极是负极
③烧杯中的液体,必须是电解质溶液
④浸入同一电解质溶液中的两个电极,是活泼性不同的二种金属(或其中一种能导电的非金属)
(1)电子 ; (2)铝 ;Al-3e-+4OH- = AlO2-+2H2O ; (3)② ; (4)①
解析试题分析:(1)实验1中Zn比铜活泼,铜与稀硫酸不反应,所以锌应为原电池的负极,Cu为正极,电流从正极流向负极,即从B极流向A极,所以由A极流向B极的是电子。
(2)实验4中电子由B极流向A极,表明负极是铝。这是由于Al可与NaOH溶液反应而Mg不反应,所以形成原电池时Al为负极,Mg为正极,负极反应式为Al-3e-+4OH- = AlO2-+2H2O。
(3)实验3中指针发生偏转,说明构成了原电池。铜是金属,碳棒是能导电的非金属,这说明铜在潮湿的空气中易发生电化学腐蚀,为自发的氧化还原反应,故答案选②。
(4)①相对活泼的金属不一定做负极,如实验4中电子由B极流向A极,Al为负极,故①错误;②负极发生氧化反应,因此失去电子的电极是负极,故②正确;③烧杯中的液体,必须是电解质溶液,原电池工作时溶液中通过离子的定向移动形成闭合回路,故③正确;④形成原电池的两极应是活泼性不同的两种金属或金属与非金属,可形成电势差而形成电流,故④正确,答案选①。
考点:考查原电池工作原理探究的实验设计与评价

工业上采用的一种污水处理方法是:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。某科研小组用此法处理污水,设计装置示意图,如图所示。
(1)实验时若污水中离子浓度较小,导电能力较差,无法使悬浮物形成浮渣。此时,应向污水中加入适量的________。
| A.BaSO4 | B.CH3CH2OH | C.Na2SO4 | D.NaOH |
①___________________________________________________;
②___________________________________________________。
(3)电极反应①和②的生成物反应得到Fe(OH)3沉淀的离子方程式是__________ ____。
(4)该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料做电极。已知负极的电极反应是CH4 +4CO32--8e-=5CO2+2H2O。则正极的电极反应是 。为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,此电池工作时必须有部分A物质参加循环,则A物质的化学式是_________。
将锌片和铜片以下图所示两种方式分别插入同浓度稀硫酸中。
(1)以下叙述中,正确的是 (填标号)。
| A.装置甲、乙中铜片表面均无气泡产生 |
| B.装置甲、乙中稀硫酸的浓度均减小 |
| C.装置乙中锌片是正极,铜片是负极 |
| D.装置乙中产生气泡的速率比装置甲快 |
 Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出。
Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出。

 含量较高,必须添加钡式剂除去SO
含量较高,必须添加钡式剂除去SO

 Na2S4+3NaBr反应原理进行工作,电解质通过泵不断在储罐和电池间循环;电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜可允许钠离子通过。
Na2S4+3NaBr反应原理进行工作,电解质通过泵不断在储罐和电池间循环;电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜可允许钠离子通过。
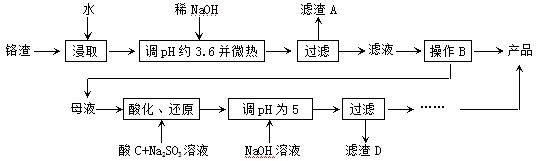
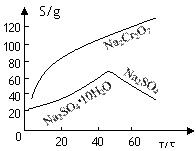
 Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的 极,其电极反应式为 。
Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的 极,其电极反应式为 。