题目内容
某种碳酸锰矿的主要成分有MnCO3、MnO2、FeCO3、MgO、SiO2、Al2O3等。已知碳酸锰难溶于水。一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,流程如下:
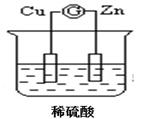
阴离子膜法电解装置如图所示:
(1)写出用稀硫酸溶解碳酸锰反应的离子方程式 。
(2)在浸出液里锰元素只以Mn2+的形式存在,且滤渣中也无MnO2,请解释原因 .
(3)(5分)已知不同金属离子生成氢氧化物沉淀所需的pH如下表:
加氨水调节溶液的pH等于6,则滤渣的成分是 ,滤液中含有的阳离子有H+和 。
(4)电解装置中箭头表示溶液中阴离子移动的方向,则A电极是 极。实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为 。
(5)该工艺之所以采用阴离子交换膜,是为了防止Mn2+进入阳极区发生副反应生成MnO2造成资浪费,写出该副反应的电极反应式 。
(1)MnCO3+2H+=Mn2++CO2↑+H2O(2)MnO2在酸性条件下被二价铁还原为Mn2+(3)Al(OH)3、Fe(OH)3 ;Mn2+、Mg2+、NH4+(4)负极 4OH--4e-=O2↑+2H2O(5)Mn2++2H2O-2e-=MnO2+4H+
解析试题分析:(1)碳酸盐遇到比碳酸酸性强的酸会溶解,在足量酸中生成CO2,故反应式MnCO3+2H+=Mn2++CO2↑+H2O(2)MnO2在酸性条件下被二价铁还原为Mn2+。溶液中Fe2+被MnO2氧化成Fe3+,使MnO2转化为Mn2+(3)由题可知Fe3+ Al3+沉淀沉淀完全的pH为3.7和4.7,生成沉淀Al(OH)3和Fe(OH)3,而Fe2+在氨水中与氧气也缓慢氧化为Fe(OH)3,而滤液中的阳离子为H+、Mn2+、Mg2+、NH4+(4)电解溶液中阴离子向阳极移动,故A电极为负极;电解池中阳极吸引阴离子,发生氧化反应化合价升高,故阳极电极反应式为4OH--4e-=O2↑+2H2O;(5)阳极发生氧化反应,故Mn2++2H2O-2e-=MnO2+4H+
考点:电解原理的应用实验;氧化还原反应的配平

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案 2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4 mol 电子时铁电极的质量减少11.2 g。请回答下列问题。
2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4 mol 电子时铁电极的质量减少11.2 g。请回答下列问题。



 Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出。
Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出。


 含量较高,必须添加钡式剂除去SO
含量较高,必须添加钡式剂除去SO