题目内容
由于Fe (OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe (OH)2沉淀,应用下图电解实验可以制得白色的纯净的Fe (OH)2沉淀。两电极材料分别为石墨和铁。
(1)b电极材料应为____,电极反应式为________________。
(2)电解液C可以是__________。
| A.纯净水 | B.NaCl溶液 | C.NaOH溶液 | D.CuCl2溶液 |
(1)铁,Fe-2e =" Fe" 2+ (2)B、C
解析试题分析:(1)b极为阳极,发生氧化反应,铁单质失去电子,电极反应式为Fe-2e- =" Fe" 2+;(2)电解液必须是电解质溶液,A错误;电解NaCl溶液,阳极为铁单质被氧化,阴极为氢离子在放电,故溶液中存在着由水电离出来的氢氧根离子,则与亚铁离子结合,生成氢氧化亚铁沉淀,B正确;电解氢氧化钠溶液,阳极为铁单质被氧化,生成的亚铁离子与溶液中的氢氧根离子结合,生成氢氧化亚铁沉淀,阴极为氢离子在放电,C符合要求;电解氯化铜溶液,阳极为铁单质被氧化,阴极为铜离子在放电,在石墨表面附着铜,亚铁离子存在电解液中,D不符合要求。
考点:电解池
点评:电解池是历年高考常考知识点,注重考查学生分析问题、解决问题的能力。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
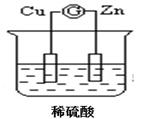
将锌片和铜片以下图所示两种方式分别插入同浓度稀硫酸中。
(1)以下叙述中,正确的是 (填标号)。
| A.装置甲、乙中铜片表面均无气泡产生 |
| B.装置甲、乙中稀硫酸的浓度均减小 |
| C.装置乙中锌片是正极,铜片是负极 |
| D.装置乙中产生气泡的速率比装置甲快 |
乙烯酮(CH2=C=O)在一定条件下能与含活泼氢的化合物发生加成反应,反应可表示 。乙烯酮在一定条件下可与下列试剂加成,其产物不正确的是
。乙烯酮在一定条件下可与下列试剂加成,其产物不正确的是
| A.与CH3OH加成生成CH3CH2COOH | B.与H2O加成生成CH3COOH |
C.与CH3COOH加成生成CH3― ―O― ―O― ―CH3 ―CH3 | D.与HCl加成生成CH3COCl |
 Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出。
Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出。
 Na2S4+3NaBr反应原理进行工作,电解质通过泵不断在储罐和电池间循环;电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜可允许钠离子通过。
Na2S4+3NaBr反应原理进行工作,电解质通过泵不断在储罐和电池间循环;电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜可允许钠离子通过。
 )的废水可以利用微生物电池除去,其原理如下图所示。
)的废水可以利用微生物电池除去,其原理如下图所示。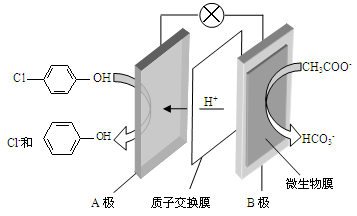
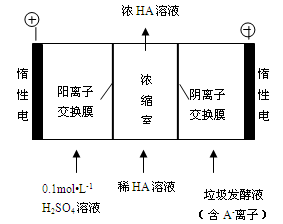
 Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的 极,其电极反应式为 。
Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的 极,其电极反应式为 。