题目内容
X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:
| 元素 | 相关信息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的基态原子最外层电子排布式为3s23p1 |
| W | W的一种核素的质量数为28,中子数为14 |
(1)W位于元素周期表第 周期第 族;W的原子半径比X的
(填“大”或“小”)。
(2)Z的第一电离能比W的 (填“大”或“小”); XY2由固态变为气态所需克服的微粒间作用力是 ;氢元素、X、Y的原子可共同形成多种分子,写出其中一种能形成同种分子间氢键的物质名称 。
(3)振荡下,向Z单质与盐酸反应后的无色溶液中滴加NaOH溶液直至过量,能观察到的现象是 ;W的单质与氢氟酸反应生成两种无色气体,该反应的化学方程式是 。
(4)在25°、101kpa下,已知13.5g的Z固体单质在Y2气体中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式是 。
(5)工业上冶炼Z时用到的催化剂是冰晶石,制取冰晶石(Na3AlF6)的化学方程式如下: 2Al(OH)3+ 12HF+ 3 A = 2Na3AlF6+ 3CO2↑+ 9H2O
根据题意完成下列填空:
①反应物A的化学式为 ,属于 晶体
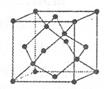
②冰晶石(Na3AlF6)是离子化合物,由两种微粒构成,冰晶石晶胞结构如下图所示,
 位于大立方体顶点和面心,
位于大立方体顶点和面心, 位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处▽所代表的微粒是 (填具体的微粒符号)
位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处▽所代表的微粒是 (填具体的微粒符号)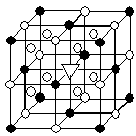
(1)三 ⅣA 大 (2)小 分子间作用力 甲醛
(3)先产生白色沉淀,后沉淀溶解 Si+4HF=SiF4↑+2H2↑
(4)2Al(s)+3O2(g)=Al2O3(s);△H=-1676kJ/mol (5)①Na2CO3 离子晶体 ②AlF6-
解析试题分析:Y是地壳中含量最高的元素,则Y是氧元素。X的最高价氧化物对应的水化物化学式为H2XO3,这说明X是第ⅣA族元素。由于X的原子序数小于Y的,则X是碳元素。Z的基态原子最外层电子排布式为3s23p1,所以Z是铝元素。W的一种核素的质量数为28,中子数为14,则质子数=28-14=14,所以W是硅元素。
(1)硅的原子序数是14,W位于元素周期表第三周期第ⅣA族;同主族自上而下原子半径逐渐增大,则W的原子半径比X的大。
(2)非金属性越强,第一电离能越大,铝是金属,所以Z的第一电离能比W的小;CO2形成的晶体是分子晶体,所以CO2由固态变为气态所需克服的微粒间作用力是分子间作用力;氢元素、X、Y的原子可共同形成多种分子,其中一种能形成同种分子间氢键的物质名称甲醛。
(3)由于氢氧化铝是两性氢氧化物,所以振荡下,向Z单质与盐酸反应后的无色溶液中滴加NaOH溶液直至过量,能观察到的现象是先产生白色沉淀,后沉淀溶解;硅单质与氢氟酸反应生成两种无色气体,反应的化学方程式是Si+4HF=SiF4↑+2H2↑。
(4)13.5g铝的物质的量是13.5g÷27g/mol=0.5mol,则2mol铝反应放出的热量是419kJ×4=1676kJ。因此在25°、101kpa下,该反应的热化学方程式是2Al(s)+3O2(g)=Al2O3(s);△H=-1676kJ/mol。
(5)①根据反应的方程式并依据原子守恒可知,A应该是碳酸钠。碳酸钠是离子化合物,属于离子晶体。
②根据晶胞的结构可知,晶胞中含有 的个数是
的个数是 个,含有
个,含有 的个数是
的个数是 。根据化学式知,Na+和AlF6- 的个数比是3:1,则白色球和黑色球之比接近3:1,要使其为3:1,则▽所代表的应该是AlF6-。
。根据化学式知,Na+和AlF6- 的个数比是3:1,则白色球和黑色球之比接近3:1,要使其为3:1,则▽所代表的应该是AlF6-。
考点:考查元素周期表的结构、第一电离能、氢键、氢氧化铝后单质硅的性质、热化学方程式的书写以及晶体类型的有关计算和判断
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的应试能力和逻辑推理能力。该题以“周期表中元素的推断”为载体,比较全面考查学生有关元素推断知识和灵活运用知识的能力。考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如下表:
| 元素 | 相关信息 |
| X | X的某种氢化物能使湿润的红色石蕊试纸变蓝 |
| Y | 单质是良好的半导体材料,广泛应用于光电信息领域 |
| Z | Z的一种核素质量数为27,中子数为14 |
| W | 最高价氧化物对应的水化物是一种不溶于水的蓝色固体 |
(1)Z位于元素周期表第 周期第 族,W基态原子的核外电子排布式为
(2)X的第一电离能比Y的 (填“大”或“小”),X的单质分子中σ键和π键的数目比为 ,Y氧化物属于 晶体。
(3)X的氢化物(X2H4)的制备方法之一是将NaC1O溶液和XH3反应制得,试写出该反应的化学方程式 。
(4)己知下列数据:
4W(s)+O2(g)=2W2O(s) △H=一337.2kJ·mol—1
2W(s)+O2(g)=2WO(s) △H=一314.6kJ·mol—1
由W2O和O2反应生成WO的热化学方程式是 。
一定温度范围内用氯化钠熔浸钾长石(主要成份为KAlSi3O8)可制得氯化钾,主要反应是:NaCl(l)+KAlSi3O8(s) KCl(l)+NaAlSi3O8(s)。
KCl(l)+NaAlSi3O8(s)。
(1)氯化钠的电子式是 。
(2)上述反应涉及的元素中,原子半径最大的是 。
(3)上述反应涉及的位于同一周期的几种元素中,有一种元素的最高价氧化物的水化物和其余元素的最价氧化物的水化物均能发生反应,该元素是 。
(4)某兴趣小组为研究上述反应中钾元素的熔出率(液体中钾元素的质量占样品质量的百分率)与温度的关系,进行实验(保持其它条件不变),获得如下数据:
| 时间(h) 熔出率 温度 | 1.5 | 2.5 | 3.0 | 3.5 | 4.0 | 5.0 |
| 800℃ | 0.054 | 0.091 | 0.127 | 0.149 | 0.165 | 0.183 |
| 830℃ | 0.481 | 0.575 | 0.626 | 0.669 | 0.685 | 0.687 |
| 860℃ | 0.515 | 0.624 | 0.671 | 0.690 | 0.689 | 0.690 |
| 950℃ | 0.669 | 0.714 | 0.710 | 0.714 | 0.714 | ―― |
①分析数据可以得出,氯化钠熔浸钾长石是 (填“放热”或“吸热”)反应。
②950℃时,欲提高熔出钾的速率可以采取的措施是 (填序号)。
a.充分搅拌
b.延长反应时间
c.增大反应体系的压强
d.将钾长石粉粹成更小的颗粒
(5)该方法制得KCl提纯后可用来冶炼金属钾。反应Na(l)+KCl(l)
 NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,用平衡原理解释该方法可行的原因是 。
NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,用平衡原理解释该方法可行的原因是 。 下列是三个不同短周期部分元素的原子半径及主要化合价:
| 元素代号 | W | R | X | Y | Z |
| 原子半径/nm | 0.037 | 0.154 | 0.066 | 0.070 | 0.077 |
| 主要化合价 | +1 | +1 | -2 | -3、+5 | +2、+4 |
试回答下列问题:
(1)五种元素中原子半径最大的元素是 (填元素符号),画出该元素的原子结构示意图: 。
(2)W、X和Y可组成一化合物,其原子个数比为4:3:2,则该化合物属 (填“离子化合物”或“共价化合物”),存在的化学键是 。写出该化合物与由W、R和X按原子个数比为1:1:1组成化合物反应的化学方程式:
。
(3)写出下列反应的化学方程式:
Z的单质与Y元素的最高价氧化物对应的水化物反应: 。
C、Si、Ge、Sn是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用.请回答下列问题:
(1)32号元素Ge的原子核外电子排布式为 ;
(2)C、Si、Sn三种元素的单质中,能够形成金属晶体的是 ;
(3)已知SnO2是离子晶体,写出其主要物理性质 ;(写出2条即可)
(4)已知:
| | CH4 | SiH4 | NH3 | PH3 |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
①CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是 ;
②CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是 ;
结合上述数据和规律判断,一定压强下HF和HCl的混合气体降温时 ;
(5))用价层电子对互斥理论推断SnBr2分子中Sn—Br的键角 120°(填“>”“<”或“=”)。
(6)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心,该化合物化学式为 ,每个Ba2+与 个O2-配位。


 mol电子,写出相应反应的化学方程式_______。
mol电子,写出相应反应的化学方程式_______。