题目内容
、某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g) 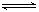 Z(g)+W(s);ΔH>0 下列叙述正确的是
Z(g)+W(s);ΔH>0 下列叙述正确的是
| A.加入少量W,逆反应速率增大 |
| B.当容器中气体压强不变时,反应达到平衡状态 |
| C.升高温度,平衡逆向移动 |
| D.平衡后加入X,上述反应的ΔH增大 |
B
解析试题分析:在反应中W是固体,所以增大W的量,反应速率不变,A错误;反应前后气体系数不等,所以压强会随着反应进行不断变化,当压强不变时,则反应达平衡,故B正确;反应ΔH>0说明正反应是个吸热反应,所以升高温度平衡向吸热反应方向移动即正反应方向移动,C错误;ΔH表示的是正反应中的反应按方程式中系数进行时,反应物完全反应转化成生成物时的反应热,所以ΔH只与系数有关,与实际参加的量无关,D错误;故选B。
考点:本题是对可逆反应的速率、化学平衡、平衡移动因素、反应热等知识的综合考查。

 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案据报道,在300 ℃、70 MPa下由二氧化碳和氢气合成乙醇已成为现实
2CO2(g) + 6H2(g) CH3CH2OH(g) + 3H2O(g)下列叙述错误的是
CH3CH2OH(g) + 3H2O(g)下列叙述错误的是
| A.使用催化剂可大大提高生产效率 |
| B.反应需在300 ℃进行可推测该反应是吸热反应 |
| C.充入大量CO2气体可提高H2的转化率 |
| D.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率 |
一定条件下,将NO2与SO2以2∶3的体积比置于密闭容器中发生上反应:NO2(g)+SO2(g) SO3(g)+NO(g),测得上述反应平衡时NO2与SO2体积比为1∶4,则平衡时SO2(g)的转化率是( )
SO3(g)+NO(g),测得上述反应平衡时NO2与SO2体积比为1∶4,则平衡时SO2(g)的转化率是( )
| A.5/6 | B.3/4 | C.5/9 | D.2/3 |
在气体反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是
①增大反应物的浓度②升高温度③增大压强④加入催化剂
| A.②④ | B.①②③ | C.②③④ | D.①②③④ |
已知反应2CO(g)===2C(s)+O2(g)的ΔH为正值,ΔS为负值。设ΔH和ΔS不随温度而变,下列说法正确的是
| A.低温下能自发进行 |
| B.高温下能自发进行 |
| C.低温下不能自发进行,高温下能自发进行 |
| D.任何温度下都不能自发进行 |
一定条件下,体积为10L的密闭容器中,1molX和1molY进行反应:2X(g)+Y(g)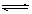 Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
| A.以X浓度变化表示的反应速率为0.001mol/(L·s) |
B.将容器体积变为20L,Z的平衡浓度变为原来的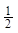 |
| C.若增大压强,则物质Y的转化率减小 |
| D.若升高温度,X的体积分数增大,则该反应的△H>0 |
一定条件下,向密闭容器中充入1 mol N2和3mol H2,发生反应:N2(g) + 3H2(g) 2NH3(g),反应达到平衡后,改变下述条件,再次达到平衡,NH3浓度与原平衡不同的是
2NH3(g),反应达到平衡后,改变下述条件,再次达到平衡,NH3浓度与原平衡不同的是
| A.保持温度和压强不变,充入1 mol NH3(g) |
| B.保持温度和体积不变,充入1 mol Ar(g) |
| C.保持温度和压强不变,充入1 mol N2(g) 和3mol H2 (g) |
| D.保持温度和压强不变,充入1 mol Ar(g) |
在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)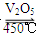 2SO3(g) ΔH<0。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
2SO3(g) ΔH<0。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是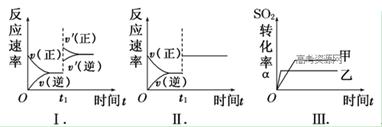
| A.图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响 |
| B.图Ⅱ表示的是t1时刻加入催化剂对反应速率的影响 |
| C.图Ⅲ表示的是催化剂对平衡的影响,且甲的催化剂效率比乙高 |
| D.图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高 |
 2C(g) ΔH=-QkJ/mol。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1 mol A和3 mol B,在一定条件下达到平衡时放出热量为Q1kJ;在相同的条件下,向乙容器中加入2 mol C达到平衡后吸收热量为Q2 kJ;已知Q1=3Q2。下列叙述不正确的是( )
2C(g) ΔH=-QkJ/mol。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1 mol A和3 mol B,在一定条件下达到平衡时放出热量为Q1kJ;在相同的条件下,向乙容器中加入2 mol C达到平衡后吸收热量为Q2 kJ;已知Q1=3Q2。下列叙述不正确的是( )