题目内容
一定条件下,体积为10L的密闭容器中,1molX和1molY进行反应:2X(g)+Y(g)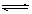 Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
| A.以X浓度变化表示的反应速率为0.001mol/(L·s) |
B.将容器体积变为20L,Z的平衡浓度变为原来的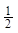 |
| C.若增大压强,则物质Y的转化率减小 |
| D.若升高温度,X的体积分数增大,则该反应的△H>0 |
A
解析试题分析:根据反应方程式可知v(X)=2v(Z)=2×0.3mol÷60s÷10L=0.001mol/(L·s),所以A正确;如果增大容器体积变为原来2倍,瞬间Z的浓度会变为原来的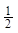 ,但是增大体积会使压强减小,平衡会逆向移动,所以Z的浓度减小,B错误;若是增大压强,平衡正向移动,则Y的转化率增大,C错误;若升高温度X的体积分数增大,说明平衡逆向移动,所以逆反应是吸热反应,正反应为放热反应,D错误,故选A。
,但是增大体积会使压强减小,平衡会逆向移动,所以Z的浓度减小,B错误;若是增大压强,平衡正向移动,则Y的转化率增大,C错误;若升高温度X的体积分数增大,说明平衡逆向移动,所以逆反应是吸热反应,正反应为放热反应,D错误,故选A。
考点:本题考查的是

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
可逆反应①X(g)+2Y(g)  2Z(g)、②2M(g)
2Z(g)、②2M(g)  N(g)+P(g)分别在密闭容器的两个反应室中进行, 反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g)分别在密闭容器的两个反应室中进行, 反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示: 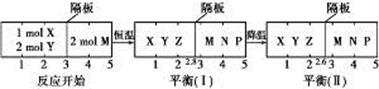
下列判断正确的是( )
| A.在平衡(Ⅰ)和平衡(Ⅱ)中, M的体积分数相等 |
B.达平衡(Ⅰ)时, X的转化率为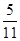 |
| C.达平衡(Ⅰ)时体系的压强与反应开始时体系的压强之比为14∶15 |
| D.反应①的正反应是吸热反应 |
、某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g) 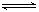 Z(g)+W(s);ΔH>0 下列叙述正确的是
Z(g)+W(s);ΔH>0 下列叙述正确的是
| A.加入少量W,逆反应速率增大 |
| B.当容器中气体压强不变时,反应达到平衡状态 |
| C.升高温度,平衡逆向移动 |
| D.平衡后加入X,上述反应的ΔH增大 |
体积相同的甲、乙两个容器中, 分别都充有等物质的量的A2和B2,在相同温度下发生反应:2A2(g)+ B2(g)=2C(g)并达到平衡,反应过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中A2的转化率为P%,则乙容器中A2的转化率为
| A.等于P% | B.大于P% | C.小于P% | D.无法判断 |
下列事实不能用勒夏特列原理解释的是
A.溴水中有下列平衡Br2+H2O HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 |
| B.合成氨反应,为提高氨的产率,理论上应采取降低温度的措施 |
C.反应CO(g)+NO2(g) CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深 CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深 |
D.对于2HI(g) H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 |
 2NH3,今有A、B、C、D四个容器,每个容器中有两种操作,两种操作分别达到平衡后,操作1中N2和操作2中NH3转化率之和一定不为1的是(起始体积相同)
2NH3,今有A、B、C、D四个容器,每个容器中有两种操作,两种操作分别达到平衡后,操作1中N2和操作2中NH3转化率之和一定不为1的是(起始体积相同) 2C(g) ΔH<0,这个反应的正确图像为( )
2C(g) ΔH<0,这个反应的正确图像为( )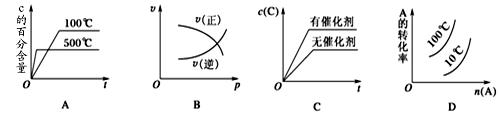
 B(g)+2C(g) ΔH=-50a kJ·mol-1
B(g)+2C(g) ΔH=-50a kJ·mol-1