题目内容
【题目】X、Y、Z、W为元素周期表前四周期的元素。其中X为形成的化合物中种类最多的元素,Y的内层电子数是最外层电子数的9倍,Z在元素周期表的各元素中电负性最大,W元素的第三电子层处于全充满状态且第四电子层只有2个电子。请回答下列问题.
(1)W元素在元素周期表中的位置为____________________________。
(2)比较XZ4和YZ2的熔沸点大小并说明理由________________________。
(3)W2+能与氨气分子形成配离子[W(NH3)4]2+。写出该配离子的结构简式(标明配位键)__。
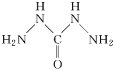
(4)X能与氢、氮,氧三种元素构成化合物XO(NH2)2,其中X原子的杂化方式为__,1mol分子中σ键的数目为__,该物质易溶水的主要原因是_______________________。
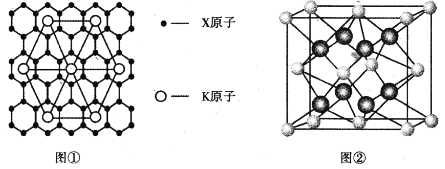
(5)X的某种晶体为层状结构,可与熔融金属钾作用、钾原子填充在各层之间,形成间隙化合物,其常见结构的平面投影如图①所示,则其化学式时表示为_________。
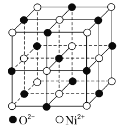
(6)元素Y与元素Z形成的晶体结构如图②所示,晶胞中Y离子的配位数为_______。
【答案】第四周期ⅡB族 CF4比CaF2熔沸点低,原因是: CF4的晶体是分子晶体,熔融和沸腾时克服的是分子间作用力,CaF2是离子晶体,熔融和沸腾时克服的是离子键,分子间作用力比离子键弱的多 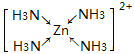 sp2 7NA CO(NH2)2分子与水分子之间能形成氢键 KC8 8
sp2 7NA CO(NH2)2分子与水分子之间能形成氢键 KC8 8
【解析】
X、Y、Z、M为元素周期表前四周期的元素,X原子核外的L层电子数是K层电子数的两倍,则X有2个电子层,最外层电子数为4,故X为C元素;Y的内层电子数是最外层电子数的9倍,Y只能处于第四周期,最外层电子数只能为2,内层电子总数为18,核外电子总数为20,故Y为Ca元素;Z在元素周期表的各元素中电负性最大,则Z为F元素,W元素的第三电子层处于全充满状态且第四电子层只有2个电子,则W的质子数为2+8+18+2=30,即W为Zn;可在此基础上对解各小题。
根据分析,X、Y、Z、W分别是C、Ca、F、Zn。
(1)W元素是Zn元素,核电荷数为30,在元素周期表中的位置为第四周期ⅡB族。答案为:第四周期ⅡB族
(2)XZ4和YZ2分别是CF4和CaF2,CF4的晶体是分子晶体,熔融和沸腾时克服的是分子间作用力,CaF2是离子晶体,熔融和沸腾时克服的是离子键。分子间作用力比离子键弱的多,所以,CF4比CaF2熔沸点低。答案为:CF4比CaF2熔沸点低,原因是: CF4的晶体是分子晶体,熔融和沸腾时克服的是分子间作用力,CaF2是离子晶体,熔融和沸腾时克服的是离子键,分子间作用力比离子键弱的多
(3)W2+和[W(NH3)4]2+分别是Zn2+和[Zn(NH3)4]2+,[Zn(NH3)4]2+中Zn2+有空轨道,每个N有一对孤对电子,所以Zn2+和4个NH3形成4个配位键,则配离子的结构简式为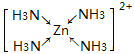 。答案为:
。答案为: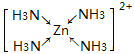
(4)X为C元素,则XO(NH2)2分子的结构简式为![]() ,C和3个原子相连,没有孤对电子,所以该分子中碳原子的杂化方式为sp2杂化,分子有1个双键,所含π键数目为1,σ键数目为1;单键数为6,均为σ键,所以σ键总数为1+6=7,所以1mol尿素中含有7molσ键,即7NA个σ键;因为
,C和3个原子相连,没有孤对电子,所以该分子中碳原子的杂化方式为sp2杂化,分子有1个双键,所含π键数目为1,σ键数目为1;单键数为6,均为σ键,所以σ键总数为1+6=7,所以1mol尿素中含有7molσ键,即7NA个σ键;因为![]() 含O和-NH2,与水分子间易形成氢键,所以该物质易溶水。答案为:sp2;7NA;CO(NH2)2分子与水分子之间能形成氢键
含O和-NH2,与水分子间易形成氢键,所以该物质易溶水。答案为:sp2;7NA;CO(NH2)2分子与水分子之间能形成氢键
(5)可以取如下图粗线所示的平行四边形为计算单位:
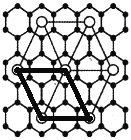
平行四边形顶点为钾,其完全占有的钾原子数是4×![]() =1,平行四边形内含有的碳原子数是8,故碳原子数和钾原子数之比是8∶1,则其化学式可表示为KC8。答案为:KC8
=1,平行四边形内含有的碳原子数是8,故碳原子数和钾原子数之比是8∶1,则其化学式可表示为KC8。答案为:KC8
(6)Y的离子是Ca2+,Z的离子是F-,所以Y和Z离子个数比为1:2,每个晶胞中位于顶点和面心的小球占有数是:8×![]() +6×
+6×![]() =4,晶体内的大球数为8,小球和大球的个数比为4:8=1:2,为保持电中性,小球应为Y离子(Ca2+),大球应为Z离子
=4,晶体内的大球数为8,小球和大球的个数比为4:8=1:2,为保持电中性,小球应为Y离子(Ca2+),大球应为Z离子

 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案