题目内容
据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实,其反应的化学方程式为:2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) 。 下列叙述正确的是
CH3CH2OH(g)+3H2O(g) 。 下列叙述正确的是
 CH3CH2OH(g)+3H2O(g) 。 下列叙述正确的是
CH3CH2OH(g)+3H2O(g) 。 下列叙述正确的是 | A.当v(CO2)=2v(CH3CH2OH)时,反应一定达到平衡状态 |
| B.当平衡向正方向移动时,平衡常数一定增大 |
| C.增大压强,可提高CO2和H2的转化率 |
| D.相同条件下,2 mol氢原子所具有的能量等于1 mol氢分子所具有的能量 |
C
试题分析:A.当v(CO2)=2v(CH3CH2OH)时,没有说明方向问题,无法判断是否达到平衡状态,错误;B、平衡常数只与温度有关,温度不变,平衡常数就是定值;D、因为 2 mol氢原子生成1 mol氢分子过程中释放能量,所以前者的能量高于后者;

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 2C(g) △H <0。达平衡后再向容器中充入 amolC(g),再达平衡后,与原平衡比较,下列叙述正确的是
2C(g) △H <0。达平衡后再向容器中充入 amolC(g),再达平衡后,与原平衡比较,下列叙述正确的是 PCl3(g)+Cl2(g) △H=+Q KJ/mol维持容器温度不变,测得容器内压强随反应时间的变化如图所示。下列说法正确的是( )
PCl3(g)+Cl2(g) △H=+Q KJ/mol维持容器温度不变,测得容器内压强随反应时间的变化如图所示。下列说法正确的是( )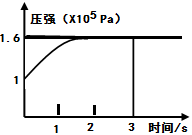
 CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如下图所示,下列说法正确的是
CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如下图所示,下列说法正确的是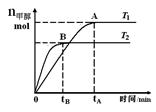
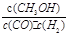
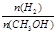 增大
增大 3Z(g)。Z的含量(Z%)随时间t的变化如下图所示。已知在t3时刻改变了某一实验条件。下列判断正确的是
3Z(g)。Z的含量(Z%)随时间t的变化如下图所示。已知在t3时刻改变了某一实验条件。下列判断正确的是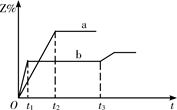
 3FcS(s)+4H2O(g) △H=a kJ ? mol-1
3FcS(s)+4H2O(g) △H=a kJ ? mol-1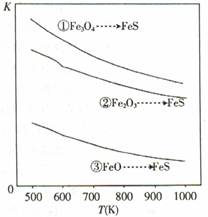
 N2(g)+2CO2(g) △H=-373.4kJ/mol
N2(g)+2CO2(g) △H=-373.4kJ/mol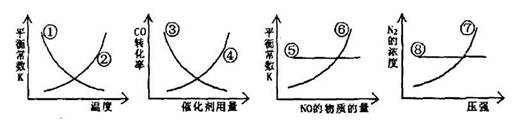
 E(g)
E(g)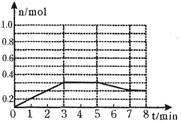
 N2O4,测得NO2转化率为a%。在温度、体积不变时,再通入1molNO2,待新平衡建立时,测得NO2的转化率为b%, a与b比较
N2O4,测得NO2转化率为a%。在温度、体积不变时,再通入1molNO2,待新平衡建立时,测得NO2的转化率为b%, a与b比较