题目内容
铁的氧化物可用于脱除煤气中的H2S,该反应原理为:
①Fe3O4 (s)+3H2S(g)+H2 (g) 3FcS(s)+4H2O(g) △H=a kJ ? mol-1
3FcS(s)+4H2O(g) △H=a kJ ? mol-1
②Fe2O3(s)+2H2S(g) + H2(g) 2FeS(s)+3H2O(g) △H=bkJ ? mol-1
2FeS(s)+3H2O(g) △H=bkJ ? mol-1
③FeO(s)+H2S(g) FeS(s)+H2O(g) △H=ckJ· mol-1
FeS(s)+H2O(g) △H=ckJ· mol-1
温度与平衡常数的关系如图,下列有关说法正确的是
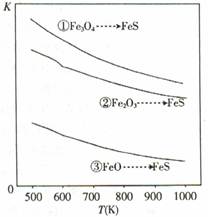
①Fe3O4 (s)+3H2S(g)+H2 (g)
 3FcS(s)+4H2O(g) △H=a kJ ? mol-1
3FcS(s)+4H2O(g) △H=a kJ ? mol-1②Fe2O3(s)+2H2S(g) + H2(g)
 2FeS(s)+3H2O(g) △H=bkJ ? mol-1
2FeS(s)+3H2O(g) △H=bkJ ? mol-1③FeO(s)+H2S(g)
 FeS(s)+H2O(g) △H=ckJ· mol-1
FeS(s)+H2O(g) △H=ckJ· mol-1温度与平衡常数的关系如图,下列有关说法正确的是

| A.a、b、c均小于0 |
| B.压强越大,H2S的脱除率越高 |
| C.温度越高,H2S的脱除率越高 |
| D.反应①、②、③的平衡常数表达式相同 |
A
试题分析:从图像可知,升高温度。三个反应的平衡常数都减小,说明平衡都向逆反应方向移动,逆反应吸热,正反应放热,故a、b、c均小于0,A正确;反应①、②是气体分子总数增加反应,增大压强平衡逆向移动,H2S的脱除率降低,B错;升高温度,平衡逆向移动,H2S的脱除率降低,C错;因三个反应中气体的化学计量数不同,因此平衡常数的表达式不同,D错。

练习册系列答案
相关题目
 CO2(g)+H2(g),一段时间后该反应达到平衡,测得CO的物质的量为0.5mol。求:
CO2(g)+H2(g),一段时间后该反应达到平衡,测得CO的物质的量为0.5mol。求: 2D(g)△H<0,测得相关数据如下,分析可知下列说法不正确的是
2D(g)△H<0,测得相关数据如下,分析可知下列说法不正确的是 3C(g)+Q(Q>0)。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是
3C(g)+Q(Q>0)。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是
 CH3CH2OH(g)+3H2O(g) 。 下列叙述正确的是
CH3CH2OH(g)+3H2O(g) 。 下列叙述正确的是  ,反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题:
,反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题:
 0(填“>”或“<”)。若在恒温恒容条件下,上述反应达到平衡,再给该平衡体系中通入SO3气体,容器内的压强 (填“增大”、“减小”或“不变”),平衡 移动(填“向正反应方何”、“逆反应方向’或“不”)若在恒温恒压条件下,上述反应达到平衡,再给该平衡体系中通人大量氮气后,体系重新达到平衡,此平衡与原平衡相比较,SO2的物质的量 __(填“增大”、“减小”或“不变”),O2的物质的量浓度 (填“增大”、“减小”或“不变”)。
0(填“>”或“<”)。若在恒温恒容条件下,上述反应达到平衡,再给该平衡体系中通入SO3气体,容器内的压强 (填“增大”、“减小”或“不变”),平衡 移动(填“向正反应方何”、“逆反应方向’或“不”)若在恒温恒压条件下,上述反应达到平衡,再给该平衡体系中通人大量氮气后,体系重新达到平衡,此平衡与原平衡相比较,SO2的物质的量 __(填“增大”、“减小”或“不变”),O2的物质的量浓度 (填“增大”、“减小”或“不变”)。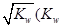 是水的离子积),则这两种溶液可为 (填字母)。
是水的离子积),则这两种溶液可为 (填字母)。 2(t-BuNO)。在20℃时,向1 L正庚烷中加入(t-BuNO)2 0.50 mol,10 min时反应达平衡,此时(t-BuNO)2的平衡转化率为65%(假设反应过程中溶液体积始终为1 L)。下列说法正确的是
2(t-BuNO)。在20℃时,向1 L正庚烷中加入(t-BuNO)2 0.50 mol,10 min时反应达平衡,此时(t-BuNO)2的平衡转化率为65%(假设反应过程中溶液体积始终为1 L)。下列说法正确的是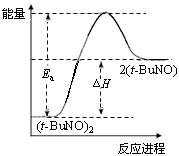
 CH3OH(g),其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图,下列说法正确的是
CH3OH(g),其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图,下列说法正确的是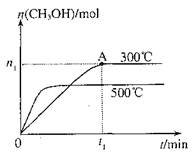
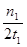 mol?L-1 min-1
mol?L-1 min-1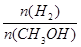 减小
减小 pC(g)+qD(g),C物质的质量分数[w(C)]与温度、压强的关系如图所示,下列判断正确的是( )
pC(g)+qD(g),C物质的质量分数[w(C)]与温度、压强的关系如图所示,下列判断正确的是( )