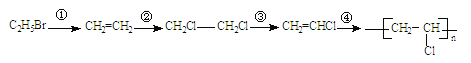��Ŀ����
����Ŀ����������(NOCl)��һ�ֺ��ɫҺ����ɫ���壬���۵�64.5�棬�е�5.5�棬��ˮ��ˮ�⡣�����л��ϳ��е���Ҫ�Լ�������NO��Cl2�ڳ��³�ѹ�ºϳɡ�
��1��ʵ�����Ʊ�ԭ����NO��Cl2��װ������ͼ��ʾ��
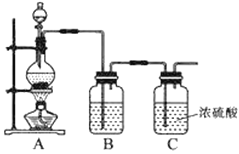
ʵ������Cl2ʱ��װ��A����ƿ�ڷ�����Ӧ�Ļ�ѧ����ʽΪ____��װ��B��ʢ�ŵ��Լ�Ϊ____��
��2���������ռ�����Cl2����D�ļ���ƿ�У���ͼʾװ���Ʊ��������ȡ�
��NOCl�����и�ԭ�Ӿ�����8�����ȶ��ṹ����NOCl�ĵ���ʽΪ____��
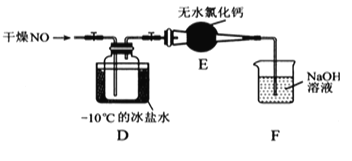
��װ��D�з����ķ�Ӧ����ʽΪ___________________��
���������װ��E������ʲô���_______________
��ijͬѧ��Ϊװ��F������Ч����β���е�ij�����壬������Ϊ_____��Ϊ�˳������β�����ɽ�β����____ͬʱͨ������������Һ�С�
��3����ҵ�Ͽ��ü�ӵ绯ѧ����ȥNO����ԭ������ͼ��ʾ���������з����ķ�ӦΪ��NO+S2O42+H2O��N2+HSO3
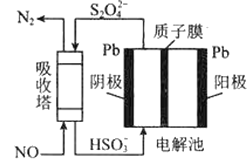
���������ڷ�����Ӧ���������뻹ԭ�����ʵ���֮��Ϊ_________��
�������ĵ缫��ӦʽΪ____________��
���𰸡�MnO2 + 4HCl��Ũ��![]() MnCl2+Cl2��+2H2O ����ʳ��ˮ
MnCl2+Cl2��+2H2O ����ʳ��ˮ ![]() 2NO +Cl2 =2NOCl F�е�ˮ�������� D װ���У��ᵼ�²�Ʒˮ�� NO O2 1:1 2HSO3 +2H++2e=S2O42+2H2O
2NO +Cl2 =2NOCl F�е�ˮ�������� D װ���У��ᵼ�²�Ʒˮ�� NO O2 1:1 2HSO3 +2H++2e=S2O42+2H2O
��������
��1��ʵ������ȡ���������ö������̺�Ũ�����ڼ��������·�Ӧ�����Ȼ��̡�������ˮ���䷴Ӧ�Ļ�ѧ����ʽΪ��MnO2+4HCl��Ũ��![]() MnCl2+Cl2��+H2O��Ũ�����ӷ��������������к����Ȼ������壬��װ��B��ʢ�ű���ʳ��ˮ���������dz�ȥCl2��HCl���壻�ʴ�Ϊ��MnO2+4HCl��Ũ��
MnCl2+Cl2��+H2O��Ũ�����ӷ��������������к����Ȼ������壬��װ��B��ʢ�ű���ʳ��ˮ���������dz�ȥCl2��HCl���壻�ʴ�Ϊ��MnO2+4HCl��Ũ��![]() MnCl2+Cl2��+H2O������ʳ��ˮ��
MnCl2+Cl2��+H2O������ʳ��ˮ��
��2����NOCl�����и�ԭ�Ӿ�����8�����ȶ��ṹ��N��O��Clԭ�������������ֱ�Ϊ5��6��7������Ҫ�γɵĵ��Ӷ�Ϊ3��2��1����NOCl�ĵ���ʽΪ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
��װ��D������ͨ��ĸ�������������NO��Ӧ��ȡNOCl���䷢���ķ�Ӧ����ʽΪ��2NO +Cl2 =2NOCl���ʴ�Ϊ��2NO +Cl2 =2NOCl��
����������(NOCl)��ˮ��ˮ�⣬�������װ��E��F�е�ˮ��������Dװ���У��ᵼ�²�Ʒˮ�⣻�ʴ�Ϊ��F�е�ˮ��������Dװ���У��ᵼ�²�Ʒˮ�⡣
��������������������Һ��Ӧ����NO��NaOH��Һ����Ӧ��Ҳ������ˮ����װ��F������Ч����β���е�NO���壻����NaOH��Һ������NO2��Ϊ�˳������β�����ɽ�β��������ͬʱͨ������������Һ�У��ʴ�Ϊ��NO��O2��
��3�����������ڷ�����Ӧ�Ļ�ѧ����ʽΪ��2NO+2S2O42+2H2O=N2+4HSO3��������������NO����ԭ����S2O42�����������뻹ԭ�����ʵ���֮��Ϊ1��1���ʴ�Ϊ��1:1��
������HSO3�õ���������S2O42����缫��ӦʽΪ��2HSO3+2H++2e=S2O42+2H2O���ʴ�Ϊ��2HSO3+2H++2e=S2O42+2H2O��

 ��˼ά������ҵ��ټ��ִ�ѧ������ϵ�д�
��˼ά������ҵ��ټ��ִ�ѧ������ϵ�д� �����������Ż�ѧϰϵ�д�
�����������Ż�ѧϰϵ�д�����Ŀ������̬����Ϊ���Ե�������̬��ת��Ϊ����̬����֮Ϊ���Ļ���ڵ���ѭ��ϵͳ�У����Ĺ����������������ʼ�������ˮ�����Ǩ�ƣ�����ѭ��ƽ�ⱻ���ƣ�����ȫ�����⡣
�� ���Ļ
��ҵ�ϳɰ��ǵ��Ļ��Ҫ;��֮һ����һ�������£���N2 �� H2 ͨ�뵽���Ϊ0.5L�ĺ��������У���Ӧ�����и����ʵ����ʵ����仯��ͼ��ʾ��

��1��10min����NH3��ʾ�÷�Ӧ��ƽ�����ʣ�v��NH3��=____________��
��2���ڵ�10min�͵�25min�ı���������ֱܷ���_________��________������ĸ����
A.���˴��� B. �����¶� C. ����NH3�����ʵ���
D.ѹ����� E.���������
��3������˵����˵���ÿ��淴Ӧ�ﵽƽ��״̬����__________������ĸ����
A. �����������ܶȲ��� B. ������ѹǿ����
C. 3v(H2)��=2v(NH3)�� D. N2��H2��NH3������֮��Ϊ1��3��2
������ת��Ϊ���Ե� ��֪��SO2��CO��NH3�ȶ����Դ���ԭ�����������ɶ��Ե���
��4����250C��101KPaʱ��N2(g)+3H2(g) ![]() 2NH3(g) ��H1= -92.4kJ/mol.
2NH3(g) ��H1= -92.4kJ/mol.
2H2(g)+O2(g)=2H2O(l) ��H2= -571.6 kJ/mol
N2(g)+O2(g)=2NO(g) ��H3= +180kJ/mol
��NO��NH3��Ӧ���ɶ��Ե����Ȼ�ѧ����ʽ______________________________��
��5�������������£����ʹ���M�ܴ�CO��NOx��Ӧ����N2������ij�ܱ������г�������ʵ���Ũ�ȵ�NO2��CO���壬ά�ֺ��º��ݣ��ڴ��������·�����Ӧ��
4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) ��H��0������������£�
N2(g)+4CO2(g) ��H��0������������£�
0min | 5min | 10min | 15min | 20min | |
c(NO2) /mol��L-1 | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
c(N2) /mol��L-1 | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
��������¶��µĻ�ѧƽ�ⳣ��K=______��
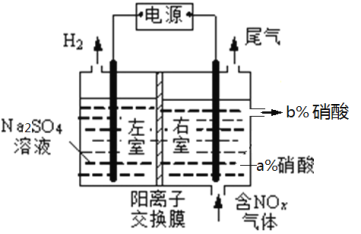
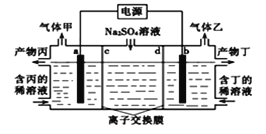
��ʵ����ģ���ⷨ����NOxװ����ͼ����ͼ�е缫��Ϊʯī�缫��������NO2�������ģ���ⷨ����ʵ�飨a<b�������ʱNO2������Ӧ�ĵ缫��Ӧʽ��_________________________________��