题目内容
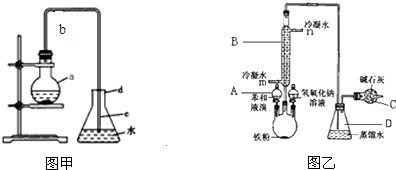
4.用含有A1203、SiO2和少量FeO•xFe2O3的铝灰制备A12(SO4)3•18H2O.,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤:
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为x;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
Ⅳ.加入MnSO4至紫红色消失,过滤;Ⅴ.浓缩、结晶、分离,得到产品.
(1)将MnO4-氧化Fe2+的离子方程式补充完整:
1MnO4-+5Fe2++8H+=1Mn2++5Fe3++4H2O
(2)已知:生成氢氧化物沉淀的pH(注:金属离子的起始浓度为0.1mol•L-1)
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | / |
(3)己知:一定条件下,MnO4-可与Mn2+反应生成MnO2,
①向Ⅲ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是生成黄绿色气体.
②Ⅳ中加入MnS04的目的是除去过量的MnO4-.
分析 向铝灰中加入过量稀H2SO4,A12O3和少量FeO•xFe2O3和硫酸反应生成硫酸铝、硫酸铁、硫酸亚铁,SiO2不反应,过滤除去二氧化硅;向滤液中加入过量KMnO4溶液,高锰酸钾把亚铁离子氧化成铁离子,调节溶液的pH约为3生成氢氧化铁沉淀,除去铁离子,过滤,滤液中含铝离子和过量的高锰酸根离子;加入硫酸锰把过量高锰酸根离子除去,再过滤,对滤液蒸发浓缩、结晶分离出硫酸铝晶体.
(1)依据氧化还原反应电子守恒和原子守恒,结合元素化合价变化分析产物和反应物;
(2)依据Ksp[Fe(OH)3]=c(Fe3+)•c3(OH-),当c(Fe3+)=1×10-5mol•L-1时,计算出溶液中的氢氧根离子的浓度,据此计算PH值;
(3)①浓盐酸和二氧化锰再加热条件下生成黄绿色气体氯气;
②加入MnSO4至紫红色消失,目的是除去过量高锰酸根离子.
解答 解:(1)反应中MnO4-→Mn2+,Fe2+→Fe3+,MnO4-系数为1,根据电子转移守恒可知,Fe2+系数为$\frac{7-2}{3-2}$=5,由元素守恒可知,Fe3+系数为5,由电荷守恒可知,由H+参加反应,其系数为8,根据元素原子守恒可知,有H2O生成,其系数为4,方程式配平为MnO4-+5 Fe2++8H+=Mn2++5Fe3++4H2O;
故答案为:1;5;8H+;1; 5; 4H2O;
(2)依据Ksp[Fe(OH)3]=c(Fe3+)•c3(OH-),当c(Fe3+)=1×10-5mol•L-1时,c(OH-)=$\root{3}{\frac{K{\;}_{sp}[Fe(OH){\;}_{3}]}{c(Fe{\;}^{3+})}}$=$\root{3}{\frac{8.0×10{\;}^{-38}}{1×1{0}^{-5}}}$=2.0×10-11mol•L-1,所以c(H+)=5.0×10-4mol•L-1,PH=3.3,
故答案为:3.3;
故答案为:pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀;
(3)一定条件下,MnO4-可与Mn2+反应生成MnO2
①向Ⅲ的沉淀中加入浓HCl并加热,二氧化锰和浓盐酸在加热条件下反应生成氯化锰、氯气和水,生成的氯气是黄绿色气体,能说明沉淀中存在MnO2的现象是生成黄绿色气体;
故答案为:生成黄绿色气体;
②MnO4-可与Mn2+反应生成MnO2,过滤除去,所以可以利用MnSO4的溶液和高锰酸钾溶液反应生成二氧化锰,把过量高锰酸根离子除去;
故答案为:除去过量的MnO4-.
点评 本题考查了镁、铝、铁及其化合物性质的应用,主要是混合物分离的方法和实验设计,加入氧化剂氧化亚铁离子,调节溶液PH是沉淀分离是解题的关键,题目难度中等.

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案| A. | 第一电离能:Y>X>Z>W | B. | 原子半径:W>X>Z>Y | ||
| C. | 电负性:Y>W>X>Z | D. | 最高正化合价:Y>W>X>Z |
| A. | 浓硫酸 | B. | 五氧二磷 | C. | 碱石灰 | D. | 氯化钙 |
| A. | Al箔插入稀HNO3中,无现象,说明Al箔表面被HNO3氧化,形成致密的氧化膜 | |
| B. | 工业上电解熔融状态的Al2O3制备Al | |
| C. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 | |
| D. | 铝制容器可盛装浓H2SO4 |
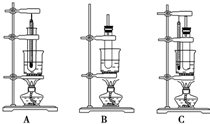 现有三种实验装置,如图,要制备硝基苯,应选用( )
现有三种实验装置,如图,要制备硝基苯,应选用( )| A. | 装置A | B. | 装置B | C. | 装置C | D. | 都不行 |
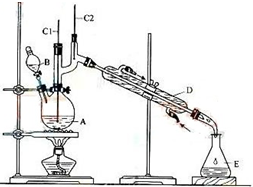 正丁醛是一种重要的化工原料.肥西中学高二某化学兴趣小组在老师的指导下利用如图装置合成正丁醛.发生的反应如下:
正丁醛是一种重要的化工原料.肥西中学高二某化学兴趣小组在老师的指导下利用如图装置合成正丁醛.发生的反应如下:CH3CH2CH2CH2O$→_{H_{2}SO_{4}加热}^{Na_{2}Cr_{2}O_{7}}$HCH3CH2CH2CHO
反应物和产物的相关数据列表如下:
| 沸点/.c | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.在A
中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90-95℃,在E中收集90℃以下的馏分.将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75-77℃馏分,产量2.0g.
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,简述理由不能,浓硫酸溶于水放出大量热,容易发生迸溅伤人.
(2)上述装置图中,B仪器的名称是分液漏斗,D仪器的名称是直形冷凝管.
(3)分液漏斗使用前必须进行的操作是c(填正确答案标号).
a.润洗b.干燥 c.查漏
(4)反应温度应保持在90-95℃,其原因是保证正丁醛及时蒸出,促使反应正向进行,又可尽量避免其被进一步氧化.
(5)正丁醇的同分异构体有许多种,请写出符合下列条件的正丁醇的同分异构体:(1)含有与正丁醇相同的官能团;(2)一定条件下能被氧化成醛.(CH3)2CHCH2OH
(6)本实验中正丁醛的产率为51%.
| t/min | 2 | 4 | 7 | 9 |
| n(I2)/mol | 0.012 | 0.011 | 0.010 | 0.010 |
(1)2min内,v(H2)=0.002mol/(L•min).
(2)下列能证明该反应已经达到平衡的是BC.
A.v正(H2)=v逆(HI) B.混合气体的颜色不再发生变化
C.混合气体中各组分的物质的量不再发生变化 D.混合气体的密度不再发生变化
(3)该温度下反应的化学平衡常数的数值是1.44.
(4)H2的平衡转化率是37.5%.
(5)温度降低时,该反应的平衡常数增大,则正反应是放热.(填“放热”或“吸热”)反应.
(6)一定可以提高平衡体系中HI百分含量的措施是A.
A.降低高温度 B.增大H2浓度 C.加入催化剂 D.降低压强.
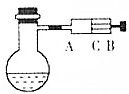 如图所示,在烧瓶中盛饱和氯水,并滴有酚酞溶液,试填写以下空白:
如图所示,在烧瓶中盛饱和氯水,并滴有酚酞溶液,试填写以下空白: