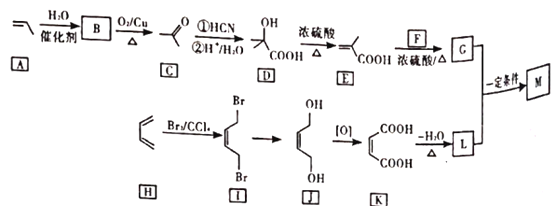
��Ŀ����
����Ŀ�����������(NH4)2Fe(SO4)2��һ����Ҫ�Ļ�ѧ�Լ������м���������ѧѧϰС����������ʵ��
��.��ѧϰС����ͼ����ʾװ���Ʊ���������泥�����ҩƷ����м��ϡ���ᡢ(NH4)2SO4��Һ��
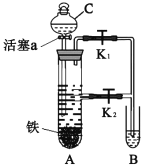
(1)װ��C��������___________��(NH4)2SO4��Һ��___________װ����(����A������B��)��
(2)װ��A�з�����Ӧ�Ļ�ѧ����ʽΪ___________��
(3)��B�е�Һ�嵹������������ʱ�������ȼ���һ���������ᡣ�������������������²��ױ�������___________��
(4)Ϊ��ֹB���Ƶõ�(NH4)2Fe(SO4)2���������ʣ�ʵ�������___________��
��.��ѧϰС��Ϊ��̽����������立ֽ����������Ϸ��֣���������笠����������ȵ�110��������ȫ�ֽ⡣���������N2��H2O��NH3����һ������������ѧϰС�����X�������ɡ�
(5)��ѧϰС�����X����ֻ�����ֿ��ܡ��ֱ��ǣ�i.SO2��ii.SO3����.___________��
(6)��С������ͼ��װ�ý��м��顣
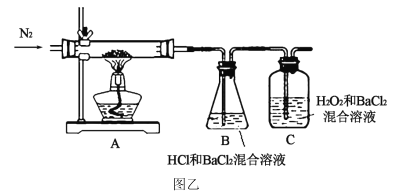
ʵ��������B��δ���ֳ�����C����Һ����ǡ��ó��Ľ�����___________��C�з�����Ӧ�����ӷ���ʽ��_________________________________��
���𰸡���Һ©�� B Fe+H2SO4�TFeSO4+H2�� ������������ˮ�� �ȴ�ֹˮ��K1���ٴ�Һ©����������a���μ�ϡ���ᣬ��B��ͨ������һ��ʱ��ر�ֹˮ��K1����K2,��Ӧ���ɵ�������������ѹ�����ɵ���������ѹ��Bװ�� SO2��SO3 X������SO2�����i.��ȷ SO2+H2O2+Ba2+= BaSO4��+2H+
��������
��.��ʵ��װ��ͼ��֪���Ʊ���������淋�ԭ��Ϊ���ȴ�ֹˮ��K1���ٴ�Һ©����������a������ϡ���ᷴӦ����������������������Ӧ���ɵ������ž�װ���еĿ�����ֹ����������������B��ͨ������һ��ʱ��ر�ֹˮ��K1����K2,��Ӧ���ɵ�������������ѹ�����ɵ���������ѹ��Bװ����������立�����Ӧ������������泥�
II.�����⣬��������笠����������ȵ�110��������ȫ�ֽ⣬���������N2˵����Ӧ��NԪ�ػ��ϼ����ߣ��ɴ˿�֪��Ӧ��SԪ�ػ��ϼ�һ�����ͣ���ԭ����һ��Ϊ��������
I.��1��װ��C�������Ƿ�Һ©�����������Һװ��װ��B�У��ʴ�Ϊ����Һ©����B��
��2��װ��A������ϡ���ᷴӦ����������������������Ӧ�Ļ�ѧ����ʽΪFe+H2SO4�TFeSO4+H2�����ʴ�Ϊ��Fe+H2SO4�TFeSO4+H2����
��3��B�е�Һ��Ϊ��������泥�Ϊ��ֹ�������ӱ��������Լ������������Ӻ�笠�����ˮ�⣬�������������Һ��������������ʱ��Ӧ�ȼ���һ���������ᣬ�����������Ӻ�笠�����ˮ�⣬�ʴ�Ϊ��������������ˮ�⣻
(4)Ϊ��ֹ�Ƶõ�(NH4)2Fe(SO4)2���������ʣ�Ӧ���γ������������������Ϊ���ȴ�ֹˮ��K1���ٴ�Һ©����������a������ϡ���ᷴӦ����������������������Ӧ���ɵ������ž�װ���еĿ�����ֹ����������������B��ͨ������һ��ʱ��ر�ֹˮ��K1����K2,��Ӧ���ɵ�������������ѹ�����ɵ���������ѹ��Bװ���У��ʴ�Ϊ���ȴ�ֹˮ��K1���ٴ�Һ©����������a���μ�ϡ���ᣬ��B��ͨ������һ��ʱ��ر�ֹˮ��K1����K2,��Ӧ���ɵ�������������ѹ�����ɵ���������ѹ��Bװ�ã�
��.��5�������⣬��������笠����������ȵ�110��������ȫ�ֽ⣬���������N2˵��NԪ�ػ��ϼ����ߣ��ɴ˿�֪��Ӧ��SԪ�ػ��ϼ�һ�����ͣ�X������һ���ж������������������ʴ�Ϊ��SO2��SO3��
��6��������ʵ��������B��δ���ֳ�����C����Һ����ǣ�˵��X���ж�������û����������C����Һ����ǵ�ԭ���Ƕ���������˫��ˮ��Ӧ�������ᣬ�������Ȼ�����Ӧ�������ᱵ��������Ӧ�Ļ�ѧ����ʽΪSO2+H2O2+Ba2+= BaSO4��+2H+���ʴ�Ϊ��X������SO2�����i.��ȷ��SO2+H2O2+Ba2+= BaSO4��+2H+��

 ��һ������ĩ�ٷֳ�̾�ϵ�д�
��һ������ĩ�ٷֳ�̾�ϵ�д�