题目内容
【题目】甲醇在工业中有广阔的用途
已知:①2CH3OH(l)+2O2(g)=2CO(g)+4H2O(l) △H=-a kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) △H=-b kJ·mol-1
(1)反应2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(1)的△H=___________。
(2)CH3OH不充分燃烧时,生成C、CO和CO2以及气态水,将所有的产物通入一个10L的密闭容器中,在一定条件下发生可逆反应:
CO(g)+ H2O(g)![]() CO2(g)+H2(g) △H>0
CO2(g)+H2(g) △H>0
①有利于提高CO平衡转化率的条件是___________。(填正确答案标号)
A.高温 B.低温 C.低压 D.高压
②下列事实能说明该反应达到平衡的是___________。(填正确答案标号)
A.体系中的颜色不发生变化 B. v正(CO)/v逆(H2)=1
C.c(CO)/c(H2)=1 D.CO2的浓度不再发生变化
③向该密闭容器中充入2 mol CO,4.8molH2O。在200℃下,20分钟后达到平衡,测得CO的转化率为60%,v(CO2)=___________;该温度下的平衡常数是___________。
(3)在加热条件下用甲醇气相法制备CO和H2时,常采用加NiO作催化剂。发生2CH3OH(l)![]() 2CO(g)+4H2(g) △H>0,日产量与温度的关系如图所示。
2CO(g)+4H2(g) △H>0,日产量与温度的关系如图所示。
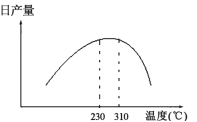
①保证较高日产量的适宜温度是______________;
②310℃以后日产量下降的原因可能是___________。
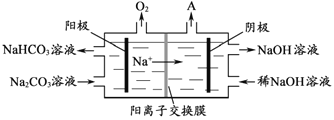
(4)21世纪甲醇燃料电池是最佳动力源之一。甲醇空气电池成为了车载电池,该燃料电池工作时的电池反应:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(1)。原理如图
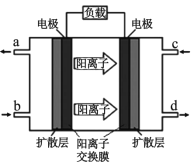
①c处应通入_________________________________;
②该电池的负极反应式为_________________________________。
【答案】—(a+b)kJ·mol-1 A BD 0.006mol/(L·min) 0.5 230~310℃ 催化剂活性降低或发生了副反应 氧气或空气 CH3OH—6e—+H2O = CO2↑+6H+
【解析】
(1)由盖斯定律计算可得;
(2)①该反应为气体体积不变的吸热反应,改变压强平衡不移动,升高温度,平衡向正反应方向移动;
②依据平衡时正反应速率等于逆反应速率,各物质浓度保持不变,以及衍生的物理量不变进行分析判断;
③依据题给数据建立三段式计算反应速率和平衡常数;
(4)由原理图中阳离子移动方向可知,左电极为负极,右电极为正极,酸性条件下,负极上CH3OH发生氧化反应生成二氧化碳,b处通入CH3OH,正极上氧气发生还原反应生成水,c处通入O2。
(1)由盖斯定律可知①+②得反应2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(1),则△H=△H1—△H2=—(a+b)kJ·mol-1,故答案为:—(a+b)kJ·mol-1;
(2)①该反应为气体体积不变的吸热反应,改变压强平衡不移动,升高温度,平衡向正反应方向移动,CO平衡转化率增大,故选A,故答案为:A;
②A、反应物和生成物都是无色气体,体系中的颜色不发生变化不能说明该反应达到平衡,错误;
B、v正(CO)/v逆(H2)=1说明正逆反应速率相等,说明该反应达到平衡,正确;
C、一定条件下可以达到c(CO)/c(H2)=1,但不能说明该反应达到平衡,错误;
D、达到化学平衡时,各物质浓度保持不变,则CO2的浓度不再发生变化说明该反应达到平衡,正确;
故选BD,故答案为:BD;
③20分钟后达到平衡,测得CO的转化率为60%,由题给数据建立如下三段式:
CO(g)+ H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
起(mol/L) 0.2 0.48 0 0
变(mol/L) 0.12 0.12 0.12 0.12
平(mol/L) 0.08 0.36 0.12 0.12
v(CO2)= 0.12mol/L/20min=0.006mol/(L·min);平衡常数K=c(CO2)c(H2)/c(CO)c(H2O)= (0.12mol/L×0.12mol/L)/( 0.08mol/L×0.36mol/L)=0.5,故答案为:0.006mol/(L·min);0.5;
(3)①由图可知230~310℃时,日产量较高,故答案为:230~310℃
②该反应为吸热反应,理论上,升高温度,平衡右移,日产量增大,由图可知,温度升高,日产量下降,可能是催化剂活性降低或发生了副反应,故答案为:催化剂活性降低或发生了副反应;
(4)由原理图中阳离子移动方向可知,左电极为负极,右电极为正极,酸性条件下,负极上CH3OH发生氧化反应生成二氧化碳,b处通入CH3OH,正极上氧气发生还原反应生成水,c处通入O2。
①由图可知,b处通入CH3OH,c处应通入O2,故答案为:氧气或空气;
②左电极为负极,负极上CH3OH发生氧化反应生成二氧化碳,电极反应式为CH3OH—6e—+H2O = CO2↑+6H+,故答案为:CH3OH—6e—+H2O = CO2↑+6H+。

【题目】Ⅰ.用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
实验序号 | A溶液 | B溶液 |
① | 20mL 0.1mol·L-1H2C2O4溶液 | 30mL 0.1 mol·L-1KMnO4溶液 |
② | 20mL 0.2mol·L-1H2C2O4溶液 | 30mL 0.1mol·L-1KMnO4溶液 |
(1)该实验探究的是____因素对化学反应速率的影响。如图一,相同时间内针筒中所得的CO2体积大小关系是___(填实验序号)。

(2)若实验①在2min末收集了2.24mLCO2(标准状况下),则在2min末,c(MnO4-)___ mol·L-1(假设混合液体积为50mL)。
(3)除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定___来比较化学反应速率。
(4)小组同学发现反应速率总是如图二,其中t1~t2时间内速率变快的主要原因可能是①产物MnSO4是该反应的催化剂、②_____。
Ⅱ.一定温度下,将一定量的N2和H2充入固定体积的密闭容器中进行反应:
N2(g)+3H2(g)![]() 2NH3(g)。
2NH3(g)。
(1)下列描述能说明该可逆反应达到化学平衡状态的有___。
A.容器内的压强不变
B.容器内气体的密度不变
C.相同时间内有3mol H-H键断裂,有6mol N-H键形成
D.c(N2):c(H2):c(NH3)=1:3:2
E.NH3的质量分数不再改变
(2)若起始时向容器中充入10mol ·L-1的N2和15mol ·L-1的H2,10min时测得容器内NH3的浓度为1.5mol ·L-1。10min内用N2表示的反应速率为___;此时H2的转化率为___。