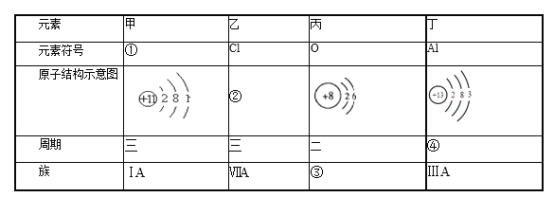
题目内容
【题目】(1)298K时,将20mL3xmol·L-1Na3AsO3、20mL3xmol·L-1I2和20mLNaOH溶液混合,发生反应:AsO![]() (aq)+I2(aq)+2OH-(aq)
(aq)+I2(aq)+2OH-(aq)![]() AsO
AsO![]() (aq)+2I-(aq)+H2O(l)。溶液中c(AsO
(aq)+2I-(aq)+H2O(l)。溶液中c(AsO![]() )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
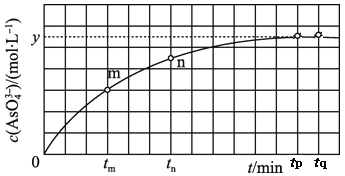
①下列可判断反应达到平衡的是__(填标号)。
a.溶液的pH不再变化
b.v(I-)=2v(AsO![]() )
)
c.![]() 不再变化
不再变化
d.c(I-)=ymol·L-1
e.![]() =
=![]() 不再变化
不再变化
②tn时,v正__v逆(填“大于”“小于”或“等于”)。
③tm时v逆__tn时v逆(填“大于”“小于”或“等于”),理由是__。
④比较产物AsO![]() 在tm~tnmin和tp~tqmin时平均反应速率的大小,前者__;(填大或小或相等)
在tm~tnmin和tp~tqmin时平均反应速率的大小,前者__;(填大或小或相等)
(2)合成氨工厂常通过测定反应前后混合气体的密度来确定氨的转化率。某工厂测得合成塔中N2、H2混合气体的密度为0.5536g/L(标准状况),从合成塔中出来的混合气体在相同条件下密度为0.693g/L(标准状况)。该合成氨厂N2的转化率___。
【答案】ac 大于 小于 tn时产物的浓度大于tm时是的产物浓度,浓度越大反应速率越快 大 25%
【解析】
(1)①a.溶液的pH不再变化,说明溶液中氢离子浓度不变,则氢氧根离子的浓度也不在变化,可以说明反应达到平衡状态,故a可判断平衡;
b.根据反应方程式可知,结合化学反应速率之比=化学计量数之比可得任意时刻v(I-)=2v(AsO![]() ),不能据此判断平衡状态,故b不可判断平衡;
),不能据此判断平衡状态,故b不可判断平衡;
c.在反应达到平衡状态之前,反应物在减少,产物在增加,则![]() 在发生变化,当达到平衡后该比值不再变化,故c可判读平衡;
在发生变化,当达到平衡后该比值不再变化,故c可判读平衡;
d. 由图像可知当反应达到平衡时:![]() ,则此时c(I-)=2ymol·L-1,因此c(I-)=ymol·L-1时反应未达到平衡状态,故d不能判断平衡;
,则此时c(I-)=2ymol·L-1,因此c(I-)=ymol·L-1时反应未达到平衡状态,故d不能判断平衡;
e. ![]() 、
、![]() 均为产物且系数比为1:2,则在反应过程中两者的浓度之比始终保持不变,因此
均为产物且系数比为1:2,则在反应过程中两者的浓度之比始终保持不变,因此![]() =
=![]() 不再变化不能说明是平衡状态,故e不可判断平衡。
不再变化不能说明是平衡状态,故e不可判断平衡。
故答案为:ac。
②由图可知tn时,反应未达平衡状态,反应正向进行才能达到平衡,则正反应速率大于逆反应速率,故答案为:大于。
③tm、tn时反应均没有到达平衡状态,tn时反应正向进行的程度大,产物浓度比tm时产物浓度大,其他条件相同时浓度越大反应速率越快,则逆反应速率tn时大,故答案为:小于;tn时产物的浓度大于tm时的产物浓度,浓度越大反应速率越。
④AsO![]() 在由图像可知tm~tnmin反应未达平衡状态,tp~tqmin时反应已经平衡,平衡后各物质的浓度保持恒定不变,则tp~tqminAsO
在由图像可知tm~tnmin反应未达平衡状态,tp~tqmin时反应已经平衡,平衡后各物质的浓度保持恒定不变,则tp~tqminAsO![]() 的浓度变化量为0,速率为0,因此tm~tnmin时AsO
的浓度变化量为0,速率为0,因此tm~tnmin时AsO![]() 平均反应速率的大,故答案为:大。
平均反应速率的大,故答案为:大。
(2)设反应前混合气体中氮气的物质的量分数为x,氢气的物质的量量分数为(1-x),依题意得:![]() ,解得x=0.4,
,解得x=0.4,
![]()
设起始氮气2mol,氢气3mol,氮气转化的物质的量为ymol,列出三段式:
![]()
起始物质的量(mol) | 2 | 3 | |
转化物质的量(mol) | y | 3y | 2y |
平衡物质的量(mol) | 2-y | 3-3y | 2y |
n(总)=(2-y)mol +(3-3y)mol +2y mol=(5-2y)mol
根据反应前后气体质量守恒可知:![]() ,解得 y=0.5mol
,解得 y=0.5mol
N2的转化率=![]() ,故答案为:25%。
,故答案为:25%。

【题目】下列实验中所用的试剂、仪器或用品![]() 夹持装置、活塞省去
夹持装置、活塞省去![]() 能够达到该目的是( )
能够达到该目的是( )
选项 | 目的 | 试剂 | 仪器或用品 |
A | 验证牺牲阳极的阴极保护 | 酸化NaCl溶液、Zn电极、Fe电极、铁氰化钾 | 烧杯、电压表、导线、胶头滴管 |
B | 铝热反应 | 氧化铁、铝粉 | 滤纸、酒精灯、木条、盛沙子的蒸发皿 |
C | 配制1.000mol/LNaCl | NaCl | 容量瓶、烧杯、玻璃棒、试剂瓶 |
D | 制备乙酸乙酯 | 乙醇、乙酸、饱和碳酸钠 | 大小试管、酒精灯 |
A.AB.BC.CD.D