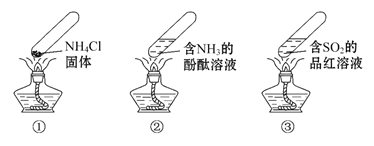
题目内容
【题目】(1)补充完成下表:(请把序号①一④的答案对应填入答题卡上) _________

(2)甲元素最高价氧化物对应的水化物呈_________性(填“酸、碱”),乙元素最高价氧化物对应的水化物的化学式为_________________
(3)甲与乙两元素的单质反应生成物的电子式为___________________
(4)比较这四种元素的原子半径大小:_____ > _____ >_____ >______ (填元素符号)
(5)甲单质与丙的氢化物反应的离子方程式为_________________________________
(6)甲元素最高价氧化物对应水化物与丁元素最高价氧化物反应的化学方程式为__________
【答案】Na、 、ⅥA、三 碱
、ⅥA、三 碱 ![]()
![]() Na Al Cl O; 2Na+2H2O=2Na++2OH-+H2↑ Al(OH)3+NaOH═NaAlO2+2H2O
Na Al Cl O; 2Na+2H2O=2Na++2OH-+H2↑ Al(OH)3+NaOH═NaAlO2+2H2O
【解析】
(1)甲原子结构示意图是 ,质子数为11,是钠元素;乙是氯元素。质子数是17,最外层有7个电子;丙是氧元素,最外层电子数是6;丁是铝元素,有3个电子层;
,质子数为11,是钠元素;乙是氯元素。质子数是17,最外层有7个电子;丙是氧元素,最外层电子数是6;丁是铝元素,有3个电子层;
(2)甲元素最高价氧化物对应的水化物是氢氧化钠;氯元素最高价氧化物对应的水化物是高氯酸;
(3)钠与氯气反应的生成物是氯化钠;
(4)电子层数越多半径越大,电子层数相同时,质子数越多半径越小;
(5)钠与水反应生成氢氧化钠和氢气;
(6)氢氧化铝是两性氢氧化物,氢氧化铝与氢氧化钠反应生成偏铝酸钠和水;
(1)甲原子结构示意图是 ,质子数为11,甲是Na元素;乙是氯元素,质子数是17,最外层有7个电子,氯的原子结构示意图是
,质子数为11,甲是Na元素;乙是氯元素,质子数是17,最外层有7个电子,氯的原子结构示意图是 ;丙是氧元素,最外层电子数是6,位于周期表第二周期、第ⅥA族;丁是铝元素,有3个电子层,位于周期表第三周期、第ⅢA族;
;丙是氧元素,最外层电子数是6,位于周期表第二周期、第ⅥA族;丁是铝元素,有3个电子层,位于周期表第三周期、第ⅢA族;
(2)甲是钠元素,钠的最高价氧化物对应的水化物是氢氧化钠,水溶液呈碱性;乙是氯元素,氯的最高价氧化物对应的水化物是高氯酸,化学式为![]() ;
;
(3)钠与氯气反应的生成物是氯化钠,氯化钠是离子化合物,电子式为![]() ;
;
(4)O原子电子层数最少,半径最小;Na、Al、Cl电子层数相同,质子数越多半径越小,原子半径大小:Na > Al >Cl>O
(5)钠与水反应生成氢氧化钠和氢气,反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑
(6) 氢氧化铝是两性氢氧化物,氢氧化铝与氢氧化钠反应生成偏铝酸钠和水,反应的化学方程式为Al(OH)3+NaOH═NaAlO2+2H2O

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案