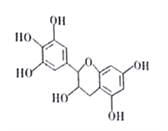
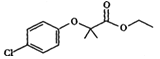
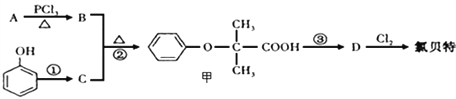
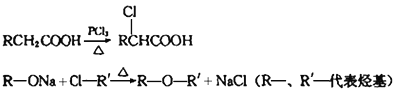题目内容
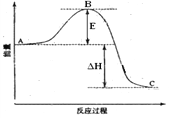
【题目】在恒温恒压下,向密闭容器中充入4 mol SO2和2 mol O2,发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g)ΔH<0。2 min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量QkJ。则下列分析正确的是
2SO3(g)ΔH<0。2 min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量QkJ。则下列分析正确的是
A. 若反应开始时容器体积为2 L,则v(SO3)=0.35 mol·L-1·min-1
B. 2 min后,向容器中再通入一定量的SO3气体,重新达到平衡时,SO2的含量降低
C. 若把条件“恒温恒压”改为“恒压绝热”,则平衡后n(SO3)大于1.4 mol
D. 若把条件“恒温恒压”改为“恒温恒容”,则平衡时放出热量小于QkJ
【答案】D
【解析】A. 若反应开始时容器体积为2L,该反应气体物质的量减小,气体体积变小,则v(SO3)>1.4/2/2mol·L-1·min-1=0.35mol·L-1·min-1,故A错误;B. 2min后,向容器中再通入一定量的SO3气体,相当于加压,平衡右移,重新达到平衡时,SO2的含量提高,故B错误;C.若把条件“恒温恒压”改为“恒压绝热”,反应放热,升温平衡左移,则平衡后n(SO3)小于1.4mol,故C错误;D. 该反应气体物质的量减小,若把条件“恒温恒压”改为“恒温恒容”,相当于减压,平衡左移,则平衡时放出热量小于QkJ,故D正确。故选D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目