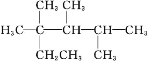
题目内容
【题目】固体粉末可能由SiO2、Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的一种或几种组成,某学习小组对该固体进行了如下实验。下列判断正确的是( )

A. 气体甲一定能使湿润的红色石蕊试纸变蓝
B. 白色沉淀甲可能是纯净物也可能是混合物
C. 无色溶液乙和无色溶液丙混合一定有无色气体生成,可能有白色沉淀生成
D. 该粉末中一定存在AlCl3、(NH4)2SO4、MgCl2,一定不存在FeCl2
【答案】C
【解析】
固体X与过量浓NaOH溶液反应生成气体甲,该气体可能为氢气或氨气,因为Al、(NH4)2SO4都能与NaOH反应分别生成氢气和氨气,且两种气体通过碱石灰后体积都不会发生变化;
生成的无色溶液甲中通入过量二氧化碳后,生成了无色溶液乙和白色沉淀乙,白色沉淀乙溶于盐酸,则白色沉淀乙只能为氢氧化铝,是偏铝酸根离子与二氧化碳反应生成的,所以无色溶液甲中含AlO2-,不含SiO32-,偏铝酸根可能是Al或氯化铝反应生成的;
固体粉末与NaOH还生成的白色沉淀甲,沉淀甲久置无变化,则固体X中一定不含FeCl2,氢氧化亚铁沉淀的颜色会发生变化,一定含有MgCl2,以此解答该题。
A. 由以上分析知,气体甲可能是NH3也可能是H2,若气体甲为氨气,则能使湿润的红色石蕊试纸变蓝,若为氢气,则不能使湿润的红色石蕊试纸变蓝,A项错误;
B. 由上述分析可知,白色沉淀甲为氢氧化镁,属于纯净物,B项错误;
C. 无色溶液乙含有碳酸氢钠,无色溶液丙中含有氯化铝和HCl,二者反应可生成二氧化碳,也可能生成氢氧化铝沉淀(取决于盐酸量的多少),C项正确;
D. 通过以上分析知,固体粉末中一定含有MgCl2、Al与AlCl3中至少存在一种,可能含有(NH4)2SO4,一定不存在FeCl2,D项错误;
答案选C。

 黄冈创优卷系列答案
黄冈创优卷系列答案【题目】某化学小组以苯甲酸(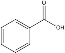 )为原料,制取苯甲酸甲酯,已知有关物质的沸点如表:
)为原料,制取苯甲酸甲酯,已知有关物质的沸点如表:
物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
沸点/℃ | 64.7 | 249 | 199.6 |
密度/g·cm-3 | 0.792 | 1.2659 | 1.0888 |
相对分子质量 | 32 | 122 | 136 |
Ⅰ.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入12.2g苯甲酸和20mL甲醇(密度约为0.79g·cm-3),再小心加入3mL浓硫酸,混匀后,投入几块碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品。
(1)浓硫酸的作用是______________;写出苯甲酸与甲醇反应的化学方程式:______________。
(2)甲和乙两位同学分别设计了如图所示的两套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去)。根据有机物的沸点,最好采用__________装置(填“甲”或“乙”)

(3)反应物CH3OH应过量,理由是______________。
Ⅱ.粗产品的精制
(4)苯甲酸甲酯粗产品中往往含有少量甲醇、苯甲酸和水等,现拟用下列流程图进行精制,请在流程图中方括号内填入操作方法的名称a______________,b______________。
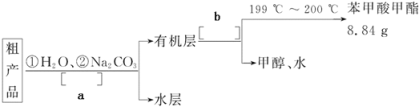
(5)通过计算,苯甲酸甲酯的产率为______________