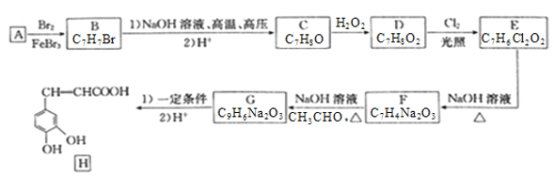
题目内容
【题目】卤代烃与金属镁在无水乙醚中反应,可得格氏试剂R—MgX,它可与醛、酮等羰基化合物加成:![]() ,得产物经水解可以得到醇,这是某些复杂醇的合成方法之一,现欲合成(CH3)3C-OH,下列所选用的卤代烃和羰基化合物的组合正确的是
,得产物经水解可以得到醇,这是某些复杂醇的合成方法之一,现欲合成(CH3)3C-OH,下列所选用的卤代烃和羰基化合物的组合正确的是
A. 乙醛和氯乙烷 B. 甲醛和1-溴丙烷
C. 丙酮和一氯甲烷 D. 甲醛和2-溴丙烷
【答案】C
【解析】由信息:![]() 可知,此反应原理为断开C=O双键,烃基加在碳原子上,MgX加在O原子上,产物水解得到醇,发生取代反应,即氢原子(H)取代MgX,现要制取(CH3)3COH,即若合成2甲基2丙醇,则反应物中碳原子数之和为4。
可知,此反应原理为断开C=O双键,烃基加在碳原子上,MgX加在O原子上,产物水解得到醇,发生取代反应,即氢原子(H)取代MgX,现要制取(CH3)3COH,即若合成2甲基2丙醇,则反应物中碳原子数之和为4。
A. 氯乙烷和乙醛反应,生成的产物经水解,得到CH3CH(OH)CH2CH3,故A错误;
B. 甲醛和1-溴丙烷反应,生成的产物经水解,得到丁醇(CH3CH2CH2CH2OH),故B错误;
C. 丙酮和一氯甲烷反应生成产物为2甲基2丙醇,故C正确;
D. 甲醛和2-溴丙烷,反应生成产物经水解得到2甲基1丙醇,不是2甲基2丙醇,故D错误;
故答案选C。

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目