题目内容
【题目】实验室从废电路板粉碎金属料(主要含金属Cu,还含少量Zn、Fe、Pb等金属)中回收铜,其实验流程如下:
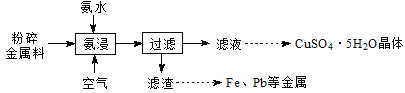
已知:一定pH范围内,Cu2+、Zn2+等能与氨形成配离子。
(1)“氨浸”在题图-1所示的装置中进行。
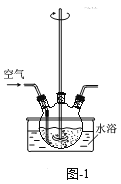
①鼓入空气,金属Cu可被氧化生成[Cu(NH3)4] 2+,其离子方程式为________;
②空气流量过大,会降低Cu元素的浸出率,其原因是_____________。
③“氨浸”时向氨水中加入一定量(NH4)2SO4固体,有利于Cu2+转化为[Cu(NH3)4]2+,其原因是_________。
(2)洗涤滤渣所得的滤液与“过滤”所得滤液合并的目的是________________。
(3)滤液中主要阳离子为[Cu(NH3)4]2+、NH![]() ,还含有一定量的[Zn(NH3)4]2+。其中铜氨配离子的离解反应可表示为:[Cu(NH3)4]2+(aq)
,还含有一定量的[Zn(NH3)4]2+。其中铜氨配离子的离解反应可表示为:[Cu(NH3)4]2+(aq) ![]() Cu2+(aq) +4NH3(aq),该反应的平衡常数表达式为________;某有机溶剂HR可高效萃取离解出的Cu2+(实现Cu2+与Zn2+的有效分离),其原理为(org表示有机相):Cu2+(aq) + 2HR(org)
Cu2+(aq) +4NH3(aq),该反应的平衡常数表达式为________;某有机溶剂HR可高效萃取离解出的Cu2+(实现Cu2+与Zn2+的有效分离),其原理为(org表示有机相):Cu2+(aq) + 2HR(org) ![]() CuR2(org) + 2H+(org);再向有机相中加入稀硫酸,反萃取得到CuSO4溶液。
CuR2(org) + 2H+(org);再向有机相中加入稀硫酸,反萃取得到CuSO4溶液。

结合题图-2和题图-3,补充完整以滤液为原料,制取较纯净CuSO4·5H2O晶体的实验方案:_______,蒸发浓缩,冷却结晶,过滤洗涤干燥。(实验中可选用的试剂:有机溶剂HR、2mol·L1硫酸、3mol·L1硫酸)。
【答案】2Cu + 8NH3 ·H2O + O2 = 2[Cu(NH3)4] 2+ + 4OH-+ 6H2O 空气流量过大,氨的挥发量增多,铜的浸出率减小 增加NH![]() 的浓度,会抑制NH3 ·H2O的电离平衡,增大溶液中NH3·H2O浓度 提高铜元素的利用率
的浓度,会抑制NH3 ·H2O的电离平衡,增大溶液中NH3·H2O浓度 提高铜元素的利用率 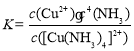 将滤液和有机溶剂HR按体积比1∶1混合,充分振荡,静置分层。分液,取有机相,加入适量2 mol·L-1硫酸,充分振荡,静置分层。分液,取水相
将滤液和有机溶剂HR按体积比1∶1混合,充分振荡,静置分层。分液,取有机相,加入适量2 mol·L-1硫酸,充分振荡,静置分层。分液,取水相
【解析】
金属料(主要含金属Cu,还含少量Zn、Fe、Pb等金属)加入氨水同时通入空气进行氨浸,Cu、Zn被氧化后和氨水形成配合物溶于水中,过滤除去Fe、Pb等金属;得到的滤液中主要阳离子为[Cu(NH3)4]2+、NH,还含有一定量的[Zn(NH3)4]2+;之后利用有机溶剂HR萃取Cu2+,萃取后再向有机相中加入稀硫酸,反萃取得到CuSO4溶液,之后经蒸发浓缩,冷却结晶,过滤洗涤干燥得到硫酸铜晶体。
(1)①鼓入空气,金属Cu可被氧化生成[Cu(NH3)4] 2+,氧化剂应为氧气,结合电子守恒和元素守恒可得离子方程式为2Cu + 8NH3 ·H2O + O2= 2[Cu(NH3)4] 2+ + 4OH-+ 6H2O;
②空气流量过大,氨的挥发量增多,导致铜的浸出率减小;
③“氨浸”时向氨水中加入一定量(NH4)2SO4固体,可增加NH![]() 的浓度,会抑制NH3 ·H2O的电离平衡,增大溶液中NH3·H2O浓度,有利于Cu2+转化为[Cu(NH3)4]2+;
的浓度,会抑制NH3 ·H2O的电离平衡,增大溶液中NH3·H2O浓度,有利于Cu2+转化为[Cu(NH3)4]2+;
(2)洗涤滤渣所得的滤液中含有铜元素,洗涤滤渣所得的滤液与“过滤”所得滤液合并可提高铜元素的利用率;
(3)铜氨配离子的离解反应可表示为:[Cu(NH3)4]2+(aq) ![]() Cu2+(aq) +4NH3(aq),其平衡常数表达式为
Cu2+(aq) +4NH3(aq),其平衡常数表达式为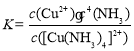 ;
;
据图可知当有机相和水相体积比为1:1时,铜的浸取率已经很高,继续增大有机相的体积浸取率有所下降,所以萃取时有机相和水相体积比取1:1;据图可知当硫酸的浓度为2mol/L和3mol/L时反萃取率相差不大,但浓度过大会造成硫酸的浪费,所以反萃取时硫酸的浓度选2mol/L,具体操作为:将滤液和有机溶剂HR按体积比1∶1混合,充分振荡,静置分层。分液,取有机相,加入适量2 mol·L-1硫酸,充分振荡,静置分层。分液,取水相,蒸发浓缩,冷却结晶,过滤洗涤干燥。

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案