题目内容
20.(1)6.02×1024个分子的物质的量是10mol.(2)3molH2O中含6molH和3molO,含有1.806×1024个H2O分子.
(3)0.15molCO2中含有氧原子数与1.806×1024个H2O分子含有的氧原子数相同.
分析 (1)根据n=$\frac{N}{{N}_{A}}$计算分子物质的量;
(2)1个H2O分子含有2个H原子、1个O原子,含有H原子物质的量为水分子的2倍,氧原子物质的量等于水分子物质的量,根据N=nNA计算水分子数目;
(3)根据根据n=$\frac{N}{{N}_{A}}$计算水分子物质的量,再根据O原子数目相等计算二氧化碳的物质的量.
解答 解:(1)6.02×1024个分子的物质的量是$\frac{6.02×1{0}^{24}}{6.02×1{0}^{23}mo{l}^{-1}}$=10mol,故答案为:10mol;
(2)3molH2O中含H原子为3mol×2=6mol、含有O原子为3mol×1=3mol,含有H2O分子数目为3mol×6.02×1023mol-1=1.806×1024,故答案为:6;3;1.806×1024;
(3)1.806×1024个H2O分子的物质的量为$\frac{1.806×1{0}^{24}}{6.02×1{0}^{23}mo{l}^{-1}}$=3mol,与之含有相等O原子数目的二氧化碳的物质的量为$\frac{3mol×1}{2}$=0.15mol,故答案为:0.15.
点评 本题考查物质的量有关计算,比较基础,注意掌握以物质的量为中心的有关计算,有利于基础知识的巩固.

练习册系列答案
相关题目
10.下列反应既是氧化还原反应,又是吸热反应的是( )
| A. | 铝片与稀H2SO4反应 | B. | Ba(OH)2•8H2O与NH4Cl反应 | ||
| C. | 甲烷在空气中燃烧 | D. | 加热条件下H2与CuO反应 |
11.下列排列顺序正确的是( )
①热稳定性:H2O>HF>H2S
②原子半径:Na>Mg>O
③酸性:H3PO4>H2SO4>HClO4
④离子半径:r(Na)<r(Cl)<r(S).
①热稳定性:H2O>HF>H2S
②原子半径:Na>Mg>O
③酸性:H3PO4>H2SO4>HClO4
④离子半径:r(Na)<r(Cl)<r(S).
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
8.化学已经渗透到人类生活的各个方面,下列说法正确的是( )
| A. | 高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路” | |
| B. | 氮的固定只有在高温、高压、催化剂的条件下才能实现 | |
| C. | 服用铬含量超标的药用胶囊会对人体健康不会造成危害 | |
| D. | 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,既能杀菌消毒又能净水 |
15.反应4A(s)+3B(g)=2C(g)+D(g),经2min后,B的浓度减少了0.6mol/L.下列反应速率的表示正确的是( )
| A. | 用A表示的反应速率是0.4 mol/(L•min) | |
| B. | 用B表示的反应速率是0.3 mol/(L•min) | |
| C. | 2 min末时的反应速率,用B表示是0.3 mol/(L•min) | |
| D. | 用D表示的反应速率为0.1 mol/L |
3.下列溶液中有关物质的量浓度关系正确的是( )
| A. | pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)═c(OH-)+c(A-) | |
| B. | 物质的量浓度相等的CH3COONa、NaOH和Na2CO3三种溶液:pH(NaOH)>pH(CH3COONa)>pH(Na2CO3) | |
| C. | NaHCO3溶液中:c(OH-)-c(H+)=c(H2CO3)-c(CO32-) | |
| D. | 10℃时pH=12的NaOH溶液与40℃时pH=12的NaOH溶液中c(OH-)相等 |
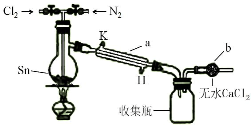 四氯化锡(SnCl4)在电子、化工等领域有重要用途.某兴趣小组拟用Sn和Cl2反应制备SnCl4.
四氯化锡(SnCl4)在电子、化工等领域有重要用途.某兴趣小组拟用Sn和Cl2反应制备SnCl4.