题目内容
【题目】Ⅰ.央视《每周质量报告》曝光了河北省一些明胶企业将皮革废料熬制成工业明胶,出售给浙江绍兴某些制药企业,最终变成药用胶囊进入患者腹中。明胶是水溶性蛋白质混合物,溶于水形成胶体。由工业明胶制成的胶囊往往含有超标的重金属Cr,从而对人体造成伤害。
①已知Fe(CrO2)2中铬元素是+3价,则其中铁元素是 价。
②CrO2-是一种酸根离子,则Fe(CrO2)2属于__ _(填“酸”、“碱”、“盐”或“氧化物”)。
③明胶的水溶液和K2SO4溶液共同具备的性质是 。
A.都不稳定,密封放置会产生沉淀
B.两者均有丁达尔现象
C.分散质粒子都可通过滤纸
Ⅱ.Cr是一种银白色金属,化学性质稳定,以+3和+6价为常见价态。工业上以铬铁矿(主要成分为FeO·Cr2O3 ,含有Al2O3、SiO2等杂质)为主要原料生产金属铬和重铬酸钠Na2Cr2O7·2H2O(已知Na2Cr2O7是一种强氧化剂),其主要工艺流程如下:
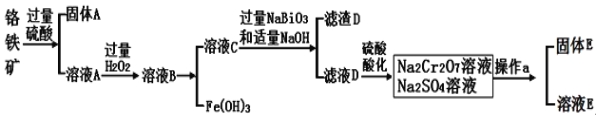
查阅资料:
常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42-
(1)工业上常采用热还原法制备金属铬,写出以Cr2O3为原料,利用铝热反应制取金属铬的化学方程式 。
(2)酸化滤液D时,用硫酸而不选用盐酸,可能的原因是 。
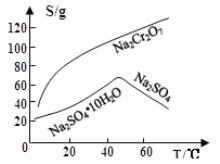
(3)固体E的主要成分是Na2SO4,根据下图分析操作a为 、 。
(4)已知含+6价铬的污水会污染环境。电镀厂产生的镀铜废水中往往含有一定量的Cr2O72-,处理该废水常用还原沉淀法,具体流程如下:

①Cr(OH)3的化学性质与Al(OH)3相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,是因为 ;(用离子方程式表示)
②下列溶液中可以代替上述流程中Na2S2O3溶液的是 (填选项序号);
A.FeSO4溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.Na2SO3溶液
③上述流程中,每消耗0.1molNa2S2O3转移0.8mole-,则加入Na2S2O3溶液时发生反应的离子方程式为 。
【答案】Ⅰ.(1)+2,盐,C;
Ⅱ.(1)Cr2O3 +2Al![]() Al2O3 +2Cr;
Al2O3 +2Cr;
(2)Cr2O72- 会氧化盐酸生成氯气,造成污染或14H++ Cr2O72-+6Cl-![]() 2Cr3++3Cl2↑+7H2O ;
2Cr3++3Cl2↑+7H2O ;
(3)蒸发结晶、 趁热过滤;
(4)①Cr(OH)3 + OH-= CrO2- +2 H2 O;② D;
③3S2O32-+4Cr2O72-+26H+=8Cr3++6SO42-+13H2O。
【解析】
试题分析:I.①O显-2价,根据化合价代数和为0,则铁元素的化合价为+2价;②此物质属于盐类;③明胶是胶体,K2SO4属于溶液,A、胶体性质是介稳性,溶液稳定,故错误;B、胶体具有丁达尔效应,溶液不具有,故错误;C、胶体和溶液可以透过滤纸,故正确;
II.(1)利用铝的还原性较强,因此反应方程式为2Al+Cr2O3![]() Al2O3+2Cr;
Al2O3+2Cr;
(2)Na2Cr2O7是一种强氧化剂,能把Cl-氧化成Cl2,14H++ Cr2O72-+6Cl-![]() 2Cr3++3Cl2↑+7H2O,氯气有毒,污染空气;(3)固体E的主要成分是Na2SO4,根据溶解度和温度的关系,在高于40℃以后,Na2SO4随着温度升高溶解度降低,因此采取操作:蒸发结晶、趁热过滤;(4)①根据信息,Cr(OH)3的化学性质与Al(OH)3的相似,Al(OH)3表现两性,溶于NaOH溶液,因此有:Cr(OH)3+OH-=CrO2-+2H2O,因此控制溶液的pH不能过高;②反应中Na2S2O3表现还原性,因此代替Na2S2O3物质也表现还原性,A、FeSO4中Fe2+以还原性为主,但会引入新杂质,故错误;B、浓硫酸表现氧化性,故错误;C、酸性高锰酸钾溶液表现氧化性,故错误;D、Na2SO3中S具有还原性,不会引入新杂质,故正确;③0.1×2×(x-2)=0.8,解得x=+6,说明Na2S2O3被氧化成SO42-,根据化合价升降法配平,因此离子反应方程式为:3S2O32-+4Cr2O72-+26H+=8Cr3++6SO42-+13H2O。
2Cr3++3Cl2↑+7H2O,氯气有毒,污染空气;(3)固体E的主要成分是Na2SO4,根据溶解度和温度的关系,在高于40℃以后,Na2SO4随着温度升高溶解度降低,因此采取操作:蒸发结晶、趁热过滤;(4)①根据信息,Cr(OH)3的化学性质与Al(OH)3的相似,Al(OH)3表现两性,溶于NaOH溶液,因此有:Cr(OH)3+OH-=CrO2-+2H2O,因此控制溶液的pH不能过高;②反应中Na2S2O3表现还原性,因此代替Na2S2O3物质也表现还原性,A、FeSO4中Fe2+以还原性为主,但会引入新杂质,故错误;B、浓硫酸表现氧化性,故错误;C、酸性高锰酸钾溶液表现氧化性,故错误;D、Na2SO3中S具有还原性,不会引入新杂质,故正确;③0.1×2×(x-2)=0.8,解得x=+6,说明Na2S2O3被氧化成SO42-,根据化合价升降法配平,因此离子反应方程式为:3S2O32-+4Cr2O72-+26H+=8Cr3++6SO42-+13H2O。