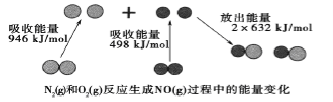
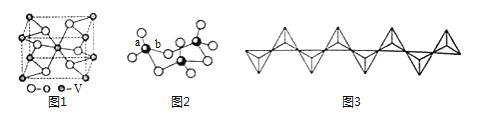
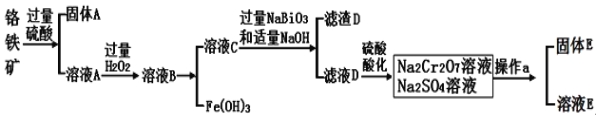
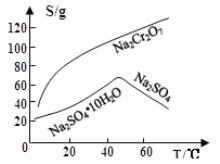
题目内容
【题目】某同学用Na2CO3配制0.10mol.L-1Na2CO3溶液的过程如图所示,你认为该同学的错误有

A. ②③ B. ④⑤ C. ①⑥ D. ①⑦
【答案】C
【解析】试题分析:配制一定物质的量浓度的溶液步骤有:计算、称量、溶解、冷却转移、洗涤转移、定容、摇匀等。操作①中称量碳酸钠质量,药品与砝码位置颠倒,正确方法应该为“左物右码”,否则导致称量的碳酸钠质量偏小,故①错误;操作②、③为溶解碳酸钠,使用玻璃棒搅拌,加速溶解过程,操作正确,故②③正确;步骤④为转移冷却后的碳酸钠溶液,需要使用玻璃棒引流,玻璃棒下端放到容量瓶刻度线一下,过程中正确,故④正确;步骤⑤为转移洗涤烧杯、和玻璃棒的溶液即直接加水定容,当加水到容量瓶刻度线1-2cm时停止,需要改用胶头滴管,该操作正确,故⑤正确;操作⑥为使用胶头滴管定容,定容时眼睛应该与容量瓶刻度线平视,不能仰视刻度线,故⑥错误;操作⑦为摇匀操作,摇匀时应该上下颠倒充分摇匀,故⑦正确;所以以上错误操作有①⑥,故选C。

练习册系列答案
相关题目