题目内容
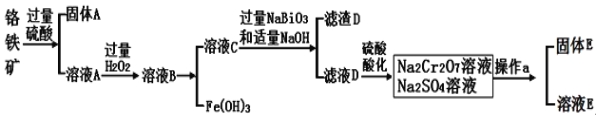
【题目】将一定质量的Mg-Al合金投入到100mL一定物质的量浓度的HCl中,合金全部溶解,向所得溶液中滴加5mol/LNaOH溶液至过量,生成沉淀质量与加入NaOH溶液的体积关系如下图所示。 求:

(1)写出20ml-160ml阶段的离子反应方程式 ;
(2)160ml-180ml阶段的离子反应方程式 ;
(3)原合金分别与足量的稀硫酸和氢氧化钠溶液反应产生气体的在同温同压下的体积比为___________。
(4)HCl的物质的量浓度为 mol/L。
【答案】(1) Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓
(2)Al(OH)3+OH-=AlO2-+2H2O
(3)7:3(4)8
【解析】
试题分析:根据图片知,0~20mL时没有沉淀生成,说明此时发生的反应为酸碱中和反应O H++OH-=H2O,20~160mL时随着NaOH的加入沉淀的量逐渐增加,此时发生的反应为Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,160~180mL时,随着NaOH的增加,沉淀的量减少,说明发生反应Al(OH)3+OH-=AlO2-+2H2O,所以m[Al(OH)3]=(19.4-11.6)g=7.8g,n[Al(OH)3]=7.8g÷78g/mol=0.1mol,n[Mg(OH)2]=11.6g÷58g/mol=0.2mol.
(1)根据以上分析可知20ml~160ml阶段的离子反应方程式为Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓;
(2)根据以上分析可知160ml~180ml阶段的离子反应方程式为Al(OH)3 + OH- = AlO2- + 2H2O;
(3)根据Mg原子守恒得n(Mg)=n[Mg(OH)2]=0.2mol,根据Al原子守恒得n(Al)=n[Al(OH)3]=0.1mol,与足量稀硫酸反应生成氢气是0.2mol+0.15mol=0.35mol;与足量氢氧化钠溶液反应时镁不反应,则产生的氢气是0.15mol,所以原合金分别与足量的稀硫酸和氢氧化钠溶液反应产生气体的在同温同压下的体积比为0.35mol:0.15mol=7:3;
(4)160mL时,溶液中的溶质为NaCl,根据原子守恒得n(NaCl) = n(HCl) = n(NaOH) = 0.16L × 5 mol/L = 0.8mol,c(HCl) = 0.8mol ÷ 0.1L = 8mol/L。

【题目】元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表列出了①~⑨九种元素在周期表中的位置。请用相关的化学术语回答下列问题:
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA[ | 0 |
2 | ⑤ | ⑥ | ⑦ | |||||
3 | ① | ③ | ④ | ⑧ | ⑨ | |||
4 | ② |
(1) 在这些元素中,最不活泼的是 非金属性最强的是___________,金属性最强的是___________;(填元素符号或化学式,下同。)
(2) 这些元素形成的最高价氧化物对应的水化物中碱性最强的 ,酸性最强的__________;
(3) ①、②、③、④、⑤这五种元素的原子半径由大到小的顺序为 ;
(4) ⑥的氢化物的电子式为 ,① 在空气中燃烧后生成产物的电子式 。