题目内容
下列不能说明氯的非金属性比硫强的事实是 ( )
①HCl比H2S稳定 ②HCl和H2S的水溶液前者的的酸性强
③HClO4酸性比H2SO4强 ④Cl2能与H2S反应生成S
⑤Cl原子能得1个电子变成稳定离子而S原子能得两个电子
⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS
| A.①②④ | B.①②⑥ | C.②⑤ | D.①③⑤ |
C
解析试题分析:①、氢化物越稳定,非金属性越强,正确;②、氢化物水溶液的酸性与非金属强弱无关系,错误;③、最高价氧化物对应水化物的酸性越强,非金属越强,正确;④、非金属性强的单质可以置换非金属性弱的单质,正确;⑤、非金属性的强弱,与得到电子的多少无关系,错误;⑥、非金属单质与可变价金属反应,能生成高价金属化合物的,其非金属性强,正确。
考点:本题考查元素非金属性强弱比较的判断。

练习册系列答案
相关题目
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为11;Y、
Z在同一周期;Z原子最外层电子数是X原子内层电子数的2倍,也是Y原子最外层电子数的2倍。下列说法中,正确的是( )
| A.离子半径:Y>X | B.气态氢化物的稳定性:Z>X |
| C.Y的氧化物中含有离子键 | D.Z的氧化物对应的水化物是弱碱 |
四种短周期元素在周期表中的相对位置如右表所示,下列说法错误的是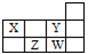
| A.X和Y元素的原子最外层电子数之和等于Z元素的原子最外层电子数的2倍 |
| B.Y元素的非金属性强于W元素的,其最高价氧化物水化物的酸性也强于W的 |
| C.X最简单氢化物溶于水呈碱性,Z最简单氢化物溶于水呈酸性 |
| D.W元素形成的单质可以从Z元素氢化物的水溶液中置换出Z单质 |
随着卤素原子半径的增加,下列递变规律正确的是( )
| A.单质的熔沸点逐渐降低 | B.卤素离子的还原性逐渐增强 |
| C.最高正化合价逐渐增大 | D.单质的氧化性逐渐增强 |
X、Y均为元素周期表中前20号元素,其简单离子的电子层结构相同,下列说法正确的是
| A.X2-的还原性一定大于Y- |
| B.由mXa+与nYb-得m+a=n-b |
| C.X、Y一定不是同周期元素 |
| D.若X的原子半径大于Y,则气态氢化物的稳定性一定是X大于Y |
短周期元素M、X、Y、Z,其中X、Y、Z在周期表中所处的位置如图所示。M元素原子的最外层电子数为其次外层电子数的2倍。X、Y、Z三种元素原子质子数之和为32。则下列说法正确的是( )
| X | | Z |
| | Y | |
A.元素M与氢元素组成化合物一定是正四面体型分子
B.X、Y两种元素的气态氢化物均能与它们对应的最高价氧化物的水化物发生反应,且反应类型相同
C.X、Z两种元素的氢化物相互反应的产物是共价化合物
D.四种元素形成的气态氢化物中,Z元素形成的氢化物热稳定性最大
根据中学化学教材所附元素周期表判断,下列叙述不正确的是( )
| A.K层电子为奇数的所有元素所在族的序数与该元素原子的K层电子数相等 |
| B.L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等 |
| C.L层电子为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等 |
| D.M层电子为奇数的所有主族元素所在族的序数与该元素原子的M层电子数相等 |
元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是( )
| A.若X+和Y2-的核外电子层结构相同,则原子序数:X>Y |
| B.由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S |
| C.硅、锗都位于金属与非金属的交界处,都可以做半导体材料 |
| D.Cs和Ba分别位于第六周期IA和IIA族,碱性:CsOH>Ba(OH)2 |