题目内容
下列对非金属元素(除稀有气体外)的相关判断正确的是
①非金属元素都是主族元素
②单质在反应中都只能作氧化剂
③氢化物常温下都是气态,所以都叫气态氢化物
④氧化物常温下都可以与水反应生成酸
⑤非金属元素R所形成的含氧酸盐(MaROb)中的R元素必定呈现正价
| A.②⑤ | B.①③ | C.①⑤ | D.③④ |
C
解析试题分析:①非金属元素不一定都是主族元素,除惰性气体外,正确②单质在反应中都只能作氧化剂,非金属单质还可以作还原剂,如氯气与水的反应,错误;③氢化物常温下不都是气态,如水,错误;④氧化物常温下不一定都能与水反应生成酸,如二氧化硅,错误;⑤非金属元素R所形成的含氧酸盐(MaROb)中的R元素必定呈现正价,正确;
考点:考查元素及其构成的单质,氢化物的性质。

 小题狂做系列答案
小题狂做系列答案由短周期元素组成的甲、乙、丙、丁四种物质分别含有两种以上元素,它们的分子质子总数均与氩原子相同。已知甲是气态氢化物,在水中分步电离出两种阴离子。下列推断合理的是 ( )
| A.某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应 |
| B.乙与氧气的摩尔质量相同,则乙一定含有极性键和非极性键 |
| C.丙中含有第二周期IV A族的元素,则丙一定是甲烷的同系物 |
| D.丁和甲中各元素质量比相同,则丁中一定含有-1价的元素 |
短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示。下列说法正确的是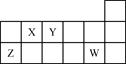
| A.原子半径的大小顺序:rZ>rY>rX |
| B.氢化物的稳定性强弱顺序:XH4>YH3>HW |
| C.Y的氢化物与W的氢化物化合所得产物中只含有共价键 |
| D.X、Y、Z、W四种元素的最高价氧化物对应水化物均能与强碱反应 |
X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表所示:
| | X | Y | Z | M | R | Q |
| 原子半径/nm | | | 0.186 | 0.074 | 0.099 | 0.143 |
| 主要化合价 | | -4,+4 | | -2 | -1,+7 | +3 |
| 其它 | 阳离子核 外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 | | | |
下列说法正确的是
A.X与M形成的化合物中含有离子键
B.Z、M、Q三种元素的简单离子的半径:M>Z>Q
C.Y与R形成的化合物中R呈正价,说明Y的非金属性比R强
D.在元素周期表中,Q位于金属与非金属的交界处,可以作半导体材料
五种短周期元素X、Y、Z、W、Q(X、Y、Z、W、Q分别代表元素符号)在周期表中的位置如图所示。下列说法中,不正确的是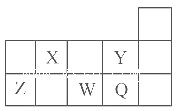
| A.X的气态氢化物与Q的气态氢化物相遇会产生白烟 |
| B.元素的非金属性:Y>Q,同浓度的氢化物水溶液的酸性:HY<HQ |
| C.形成简单离子的半径从小到大的顺序是:Y- <Q- <W2- |
| D.Z的最高价氧化物可溶于水,也能溶于强碱溶液 |
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为11;Y、
Z在同一周期;Z原子最外层电子数是X原子内层电子数的2倍,也是Y原子最外层电子数的2倍。下列说法中,正确的是( )
| A.离子半径:Y>X | B.气态氢化物的稳定性:Z>X |
| C.Y的氧化物中含有离子键 | D.Z的氧化物对应的水化物是弱碱 |
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15;X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状态下的密度为0.76g ? L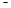 1;W的质子数是X、Y、Z、M四种元素质子数之和的1/2 。下列说法正确的是( )
1;W的质子数是X、Y、Z、M四种元素质子数之和的1/2 。下列说法正确的是( )
| A.原子半径:W>Z>Y>X>M |
| B.XZ2、X2M2、W2Z2均为共价化合物 |
| C.由X元素形成的单质不一定是原子晶体 |
| D.由Y、Z、M三种元素形成的化合物一定只有共价键 |
a、b、c、d、e是同周期的五种元素,a和b的最高价氧化物的水化物显碱性,且将a、b相连浸入稀硫酸中时,a溶解而b表面有气泡产生;c和d的气态氢化物的还原性d>c,五种元素的原子,得失电子后所形成的简单离子中,e的离子半径最小,则它们的原子序数由小到大的顺序是( )
| A.a、b、e、d、c | B.e、d、a、b、c |
| C.b、a、e、d、c | D.a、b、d、c、e |
X、Y均为元素周期表中前20号元素,其简单离子的电子层结构相同,下列说法正确的是
| A.X2-的还原性一定大于Y- |
| B.由mXa+与nYb-得m+a=n-b |
| C.X、Y一定不是同周期元素 |
| D.若X的原子半径大于Y,则气态氢化物的稳定性一定是X大于Y |