题目内容
【题目】I、依据事实,写出下列反应的热化学方程式。
(1)在25 ℃、101 kPa下,1 g甲烷燃烧生成CO2和液态水时放热55.625 kJ。则表示甲烷燃烧热的热化学方程式为________________________。
(2)若适量的N2和O2完全反应,每生成23 g NO2需要吸收16.95 kJ热量,则表示该反应的热化学方程式为______________。
(3)在25 ℃、101 kPa条件下,C(s)、H2(g)、CH3COOH(1)的燃烧热分别为393.5 kJ/mol、285.8 kJ/mol、870.3 kJ/mol,则2C(s)+2H2(g)+O2(g)===CH3COOH(1)的反应热ΔH为________。
II、锌锰干电池是应用最普遍的电池之一。其基本反应为:
X极:Zn-2e-===Zn2+
Y极:2MnO2+2NH![]() +2e-===Mn2O3+2NH3+H2O
+2e-===Mn2O3+2NH3+H2O
(1)X是电池的________(填“正”或“负”,下同)极,Y是电池的________极。
(2)该电池总反应的离子方程式为:_______________________。
(3)若反应消耗16.25gZn,则电池中转移电子的物质的量为________。
【答案】 CH4(g)+2O2(g)===CO2(g)+2H2O(1) ΔH=-890kJ·mol-1 N2(g)+2O2(g)===2NO2(g) ΔH=+67.8 kJ·mol-1 -488.3 kJ/mol 负 正 Zn+2MnO2+2NH![]() ===Zn2++Mn2O3+2NH3+H2O 0.5mol
===Zn2++Mn2O3+2NH3+H2O 0.5mol
【解析】试题分析:I、(1)燃烧热是指在25℃、101kPa下,1mol纯净物完全燃烧生成稳定的氧化物放出的热量,表示燃烧热的热化学方程式中可燃物的物质的量必须为1mol,产物必须为稳定氧化物;
(2)适量的N2和O2完全反应,每生成23克NO2需要吸收16.95kJ热量,所以每生成92克NO2需要吸收67.8kJ热量;
(3)根据盖斯定律计算2C(s)+2H2(g)+O2(g)===CH3COOH(1)的焓变;
II、(1)原电池中负极发生氧化反应,正极发生还原反应;(2)电池总反应的离子方程式=正极反应式+负极反应式;(3)根据负极反应式计算消耗16.25gZn,电池中转移电子的物质的量。
解析:I、(1)燃烧热是指在25℃、101kPa下,1mol纯净物完全燃烧生成稳定的氧化物放出的热量,则表示甲烷燃烧热的热化学方程式为:CH4(g)+2O2(g)===CO2(g)+2H2O(1) ΔH=-890kJ·mol-1
(2)适量的N2和O2完全反应,每生成23克NO2需要吸收16.95kJ热量,所以每生成92克NO2需要吸收67.8kJ热量;该反应的热化学方程式为N2(g)+2O2(g)===2NO2(g) ΔH=+67.8 kJ·mol-1
(3) 由题意可知:C(s)+O2(g)=CO2(g);ΔH=-393.5 kJ/mol ①
H2(g)+![]() O2 (g)=H2O(l);ΔH=-285.8 kJ/mol ②
O2 (g)=H2O(l);ΔH=-285.8 kJ/mol ②
CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l);ΔH=-870.3 kJ/mol ③
①×2+②×2-③即得:2C(s)+2H2(g)+O2(g)=CH3COOH(l);ΔH=-488.3 kJ/mol;
II、(1)原电池中负极发生氧化反应,正极发生还原反应;(1)X是电池的负极,Y是电池的正极;(2)电池总反应的离子方程式=正极反应式+负极反应式,该电池总反应的离子方程式为:Zn+2MnO2+2NH![]() ===Zn2++Mn2O3+2NH3+H2O;
===Zn2++Mn2O3+2NH3+H2O;
(3)

X=0.5mol

【题目】碳、硫和氮的氧化物与大气污染密切相关,对CO2、SO2和NO2的研究很有意义.
(1)科学家发现NOx与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
I:2NO2(g)+NaCl(g) ![]() NaNO3(g)+ClNO(g) ΔH1<0(平衡常数为K1)
NaNO3(g)+ClNO(g) ΔH1<0(平衡常数为K1)
II:2NO(g)+ Cl(g) ![]() 2ClNO(g) ΔH2<0(平衡常数为K2)
2ClNO(g) ΔH2<0(平衡常数为K2)
III:4NO2(g)+2NaCl(g) ![]() 2NaNO2(g)+2NO(g)+Cl2(g) ΔH3 (平衡常数为K3)
2NaNO2(g)+2NO(g)+Cl2(g) ΔH3 (平衡常数为K3)
反应III中K3=___________(用K1、K2表示),ΔH3 =_______(用ΔH1、ΔH2表示)。若反应II在恒温、恒容条件下进行,能判断该反应一定达到平衡状态的标志是________________。
A.容器内混合气体的压强保持不变
B.v正(NO)=v逆(Cl2)
C.容器内混合气体的密度保持不变
D.容器内混合气体的平均相对分子质量保持不变
(2)汽车尾气中排放的NOx和CO会污染环境,在汽车尾气系统中安装催化转化器,可有效降低NOx和CO的排放,为了模拟应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO(g)和CO(g)的浓度如下表:
N2(g)+2CO2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO(g)和CO(g)的浓度如下表:
时间/S | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(10-4mol/L) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(10-3mol/L) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
平衡时,NO的转化率ɑ(NO)=_________________,
此溫度下,该反应的平衡常数K=_______________。
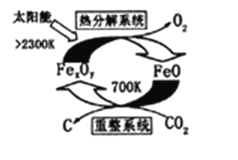
(3)科学家提出由CO2制取C的工艺如图所示。已知:在重整系统中n(FeO): n(CO2)=5 : 1则在“热分解系统”中,FexOy的化学式为__________________。
(4)NQx可“变废为宝”,由NO电解可制备NH4NO3,其工作原理如图所示(M、N为多孔电极)。为使电解产物全部转化为NH4NO3,需向电解产物中补充适量NH3。电解时M和电源________极(填“正或负”)相连,书写N极发生的电极反应式_____________________。
【题目】碳酸锰(MnCO3)是制造电信器材的软磁铁氧体,也用作脱硫的催化剂,瓷釉、涂料和清漆的颜料。工业上利用软锰矿(主要成分是MnO2,还含有Fe2O3、CaCO3、CuO等杂质)制取碳酸锰的流程如下图所示:
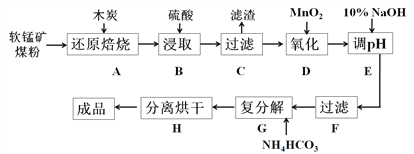
已知:还原焙烧主反应为:2MnO2+C![]() 2MnO+CO2↑。
2MnO+CO2↑。
可能用到的数据如下:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Mn(OH)2 |
开始沉淀pH | 1.5 | 6.5 | 4.2 | 8.3 |
沉淀完全pH | 3.7 | 9.7 | 7.4 | 9.8 |
根据要求回答下列问题:
(1)在实验室进行步骤A,需要用到的仪器为________________,步骤B中若采用质量分数为35%的硫酸(密度ρ=1.26 g/cm3),则其物质的量浓度为_________。
(2)步骤C中得到的滤渣主要成分是_______________,步骤D中还原剂与氧化剂的物质的量之比为__________。
(3)步骤E中调节pH的范围为________,其目的是_____________________________。
(4)步骤G的离子方程式为___________________,若Mn2+沉淀完全时测得溶液中CO32-的浓度为2.2×10-6 mol/L,则Ksp(MnCO3)=__________。
(5)实验室可以用Na2S2O8溶液来检验Mn2+是否完全发生反应,原理为:
Mn2++S2O82-+H2O=H++SO42-+MnO4-,
①请配平上述离子方程式____________________________;
②确认Mn2+离子已经完全反应的现象是_______________________________。