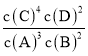题目内容
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.12.4 g白磷(P4)中所含的P-P键数目为0.6 NA
B.40 g SiC晶体中含有SiC分子的数目为NA个
C.1 mol麦芽糖完全水解后产生的葡萄糖分子数目为NA
D.标准状况下,2 mol Na2O2与44.8 L SO2完全反应,转移的电子数目为2NA
【答案】A
【解析】
A.12. 4g白磷含有![]() 的物质的量为0.1mol,0.1mol
的物质的量为0.1mol,0.1mol![]() 分子中含有
分子中含有![]() 键的物质的量为:
键的物质的量为:![]() ,所含
,所含![]() 键数目为0.6NA, A正确;
键数目为0.6NA, A正确;
B.![]() 晶体为原子晶体,不存在
晶体为原子晶体,不存在![]() 分子,B错误;
分子,B错误;
C.麦芽糖的水解产物全部为葡萄糖,则1 mol麦芽糖水解后产生2mol葡萄糖,即2NA个, C错误;
D.![]() ,则2 mol
,则2 mol![]() 与44.8 L
与44.8 L![]() (等于2mol)完全反应,转移的电子数目为4NA,D错误;
(等于2mol)完全反应,转移的电子数目为4NA,D错误;
答案选A。

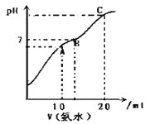
【题目】短周期元素X、Y、Z、W在周期表中的位置关系如图所示,已知在同周期元素的常见简单离子中,W的简单离子半径最小,X、Y、Z、W的单质及其化合物在日常生活中用途极其广泛.
X | Y | Z | |
W |
(1)X元素在元素周期表中的位置_____________________.
(2)X 、Y、Z元素的氢化物均有两种或两种以上,其中一定条件下,液态YH3与液态H2Z可以发生类似方式电离,则液态YH3中阴离子的电子式为____________.
(3)超细WY粉末被应用于大规模集成电路领域.其制作原理为W2Z3、Y2、X在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1:1;其反应的化学方程式为______.
(4)以W为材料制成的容器在空气中具有自我保护作用,这种容器______![]() 填“能”或“不能”
填“能”或“不能”![]() 用来腌制咸菜,原因是______.
用来腌制咸菜,原因是______.
(5)某汽车尾气分析仪以燃料电池为工作原理测定XZ的浓度,其装置如图所示,该电池中电解质为氧化钇![]() 氧化钠,其中Z2-可以在固体介质NASICON中自由移动.则负极的反应式______
氧化钠,其中Z2-可以在固体介质NASICON中自由移动.则负极的反应式______![]() 关于该电池的下列说法,正确的是______
关于该电池的下列说法,正确的是______
A 工作时电极b作正极,Z2-通过固体介质NASICON由电极b流向电极a
B 工作时电流由电极a通过传感器流向电极b
C 传感器中通过的电流越大,尾气中XZ的含量越高
(6)由元素X与元素Z组成的某种阴离子具有还原性,能被酸性KMnO4氧化,请填写相应的离子,并给予配平:____________![]() ______
______![]() ______
______![]() ______
______![]() ______
______![]() ______
______![]()

【题目】碱式碳酸钴[Cox(OH)y(CO3)z]常用作电子材料,磁性材料的添加剂,受热时可分解生成三种氧化物。为了确定其组成,某化学兴趣小组同学设计了如图所示装置进行实验。
(1)请完成下列实验步骤:
①称取3.65g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,并检验装置气密性;
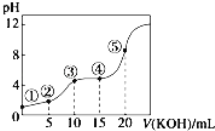
③加热甲中玻璃管,当乙装置中________________________(填实验现象),停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;⑤计算。
(2)步骤④中缓缓通入空气数分钟的目的是_________________________________________。
(3)某同学认为上述实验装置中存在一个明显缺陷,为解决这一问题,可选用下列装置中的____(填字母)连接在装置______之前(填“甲”或“乙”或“丙”或“丁”)。
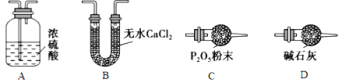
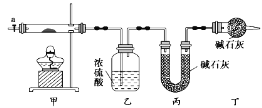
(4)若按正确装置进行实验,测得如下数据:则该碱式碳酸钴的化学式为______________。
乙装置的质量/g | 丙装置的质量/g | |
加热前 | 80.00 | 62.00 |
加热后 | 80.36 | 62.88 |
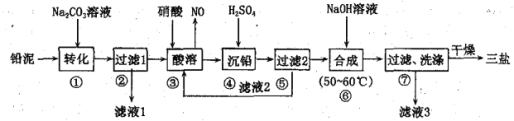
(5)CoCl2·6H2O常用作多彩水泥的添加剂,以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种工艺如下:
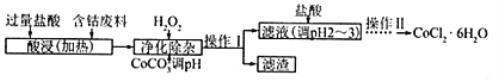
已知:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
①净化除杂质时,加入H2O2发生反应的离子方程式为__________________________________。
②加入CoCO3调pH除杂得到滤渣Al(OH)3、Fe(OH)3,则pH应调节至_____。(填pH值的范围)
③加盐酸调整pH为2~3的目的为_____________________________________。
④操作Ⅱ过程为_________________________________(填操作名称)、过滤。