题目内容
【题目】三盐基硫酸铅(3PbO·PbSO4·H2O)简称三盐,白色或微黄色粉末,稍带甜味、有毒。200℃以上开始失去结晶水,不溶于水及有机溶剂。可用作聚氯乙烯的热稳定剂。以100.0t铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如下图所示。
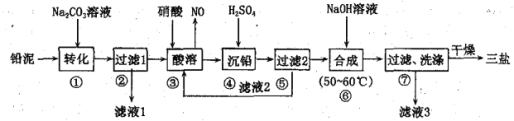
已知:Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13。请回答下列问题
(1)步骤①转化的目的是将PbSO4转化为PbCO3,反应的离子方程式为___________________。
(2)滤液3中的主要溶质为_____________(填化学式)。
(3)步骤③酸溶时,铅与硝酸反应生成Pb(NO3)2和NO的离子方程式为____________________。
(4)滤液2中可循环利用的溶质为___________(填化学式)。若步骤④沉铅后的滤液中c(Pb2+)=1.82×10-5mol·L-1,则此时c(SO42-)为___________mol·L-1
(5)步骤⑥合成三盐的化学方程式为____________________________。若得到纯净干燥的三盐49.50 t,假设铅泥中的铅元素有80.00%转化为三盐,则铅泥中铅元素的质量分数为_____。[已知:三盐(3PbO·PbSO4·H2O)的相对分子质量为990,注意保留正确的有效数字]
【答案】CO32-+PbSO4=SO42-+PbCO3 Na2SO4 3Pb+8H++2NO3-=3Pb2++2NO↑+4H2O HNO3 1.0×10-3 4 PbSO4+6NaOH![]() 3Na2SO4+3PbOPbSO4H2O+2H2O 51.75%
3Na2SO4+3PbOPbSO4H2O+2H2O 51.75%
【解析】
以100.0t铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐:向铅泥中加Na2CO3溶液是将PbSO4转化成PbCO3,Na2CO3(aq)+PbSO4(s)=Na2SO4(aq)+PbCO3(s),所以滤液Ⅰ的溶质主要是Na2SO4和过量的Na2CO3,Pb、PbO和PbCO3在硝酸的作用下反应:3Pb+8HNO3=Pb(NO3)2+2NO↑+4H2O、PbCO3+2HNO3=Pb(NO3)2+CO2↑+H2O、PbO+2HNO3=Pb(NO3)2+2H2O,均转化成Pb(NO3)2,Pb(NO3)2中加稀H2SO4转化成PbSO4和硝酸,过滤的滤液为HNO3,可循环利用,向硫酸铅中加入氢氧化钠合成三盐和硫酸钠,![]() ,滤液3主要是硫酸钠,洗涤沉淀干燥得到三盐,以此解答该题。
,滤液3主要是硫酸钠,洗涤沉淀干燥得到三盐,以此解答该题。
(1)由题可知,碳酸铅的Ksp小于硫酸铅,故加入碳酸钠的目的是将硫酸铅转化为碳酸铅,属于沉淀的转化,反应的离子方程式为![]() ;
;
故答案为:![]() ;
;
(2)根据元素守恒,故可知滤液3的主要溶质是![]() ;
;
答案为:![]() ;
;
(3)铅与硝酸反应生成![]() 和
和![]() ,根据氧化还原反应规律配平即可,
,根据氧化还原反应规律配平即可,![]() ;
;
答案为:![]() ;
;
(4)![]() 、
、![]() 和
和![]() 在可以在硝酸的作用下生成
在可以在硝酸的作用下生成![]() ,而
,而![]() 可以在稀硫酸的作用下生成
可以在稀硫酸的作用下生成![]() 、
、![]() ,其中
,其中![]() 可以重复使用;由于
可以重复使用;由于![]() ,而
,而![]() ,则可算出
,则可算出 ;
;
故答案为:![]() ;
;![]() ;
;
(5)步骤⑥参与反应的物质为:![]() 和
和![]() ,该反应的方程式为:
,该反应的方程式为:![]() ,若得到纯净干燥的三盐49.5t,可算出含铅的质量为
,若得到纯净干燥的三盐49.5t,可算出含铅的质量为![]() 。设铅泥中含铅的质量分数为
。设铅泥中含铅的质量分数为![]() ,则100t铅泥中铅元素为100
,则100t铅泥中铅元素为100![]() ,而铅泥中的铅元素有80%转化为三盐,有41.4t,即
,而铅泥中的铅元素有80%转化为三盐,有41.4t,即![]() ,解得
,解得![]() ;
;
故答案为:![]() ;
;![]() 。
。

 名校课堂系列答案
名校课堂系列答案