题目内容
17.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,无二次污染的绿色水处理剂.工业上是先制得高铁酸钠,然后在低温下,在高铁酸钠溶液中加入KOH至饱和就可析出高铁酸钾.制备方法有:①湿法:次氯酸盐氧化法 ②干法:高温过氧化物法.(1)湿法制备的主要反应方程为,Fe(OH)3+NaClO+NaOH→Na2FeO4+NaCl+H2O,配平上述反应化学方程式.
(2)干法制备中牵涉到的物质有:FeSO4、Na2FeO4、Na2SO4、Na2O2,发生氧化反应的过程是:FeSO4→Na2FeO4
(3)制备相同质量Na2FeO4时转移的电子数,湿法制备干法备<(填“>”“<”或“=”).
(4)若将湿法制备的化学反应设计成原电池,则在正极生成的离子是Cl-(填离子符号),检验此离子常用的试剂组是AgNO3和稀HNO3
(5)NaClO是家用“84”消毒液的有效成分,请用化学方程式说明其家用工作原理:NaClO+CO2+H2O=NaHCO3+HClO;若该反应中的两种钠盐的浓度相同,写出两种阴离子的浓度大小关系:[ClO-]<[HCO3-].
分析 (1)在反应Fe(OH)3+NaClO+NaOH→Na2FeO4+NaCl+H2O中,铁从+3价升为+6价,氯从+1价降为-1价,根据电子得失守恒及元素守恒配平化学方程式;
(2)干法制备中:FeSO4被氧化成Na2FeO4;
(3)干法中发生反应2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,每生成2molNa2FeO4,转移电子数=化合价升高数=化合价降低数=10mol,所以每生成1molNa2FeO4共转移5mol电子,湿法制备的过程中Fe(OH)3→Na2FeO4,所以每生成1molNa2FeO4共转移3mol电子;
(4)在原电池中正极是氧化剂发生还原反应,结合氧化还原的方程式可判断正极产生的离子,检验氯离子通常用硝酸酸化的硝酸银;
(5)NaClO与空气中的二氧化碳反应产生次氯酸,次氯酸有强氧化性,能杀菌消毒,由于碳酸的酸性强于次氯酸,所以次氯酸根离子的水解程度大于碳酸氢根离子,据此答题.
解答 解:(1)在反应Fe(OH)3+NaClO+NaOH→Na2FeO4+NaCl+H2O中,铁从+3价升为+6价,氯从+1价降为-1价,反应的化学方程式为2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O,
故答案为:2、3、4、2、3、5;
(2)干法制备中:FeSO4中铁为+2价,Na2FeO4中铁为+6价,所以FeSO4被氧化成Na2FeO4,发生氧化反应的过程是 FeSO4→Na2FeO4,
故答案为:FeSO4→Na2FeO4;
(3)干法中发生反应2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,每生成2molNa2FeO4,转移电子数=化合价升高数=化合价降低数=10mol,所以每生成1molNa2FeO4共转移5mol电子,湿法制备的过程中Fe(OH)3→Na2FeO4,所以每生成1molNa2FeO4共转移3mol电子,所以制备相同质量Na2FeO4时转移的电子数,湿法制备<干法制备,
故答案为:<;
(4)在原电池中正极是氧化剂发生还原反应,根据氧化还原的方程式2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O 可知,次氯酸根在正极发生还原反应生成了氯离子,检验氯离子通常用硝酸酸化的硝酸银,
故答案为:Cl-;AgNO3和稀 HNO3;
(5)NaClO与空气中的二氧化碳反应产生次氯酸,次氯酸有强氧化性,能杀菌消毒,反应的方程式为NaClO+CO2+H2O=NaHCO3+HClO,由于碳酸的酸性强于次氯酸,次氯酸根离子的水解程度大于碳酸氢根离子,所以在等浓度的次氯酸钠和碳酸氢钠溶液中)[ClO-]<[HCO3-],
故答案为:NaClO+CO2+H2O=NaHCO3+HClO;[ClO-];[HCO3-].
点评 本题考查氧化还原反应,为高频考点,把握习题中的信息及反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,题目难度不大.

 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案| A. | 1.00mol | B. | 0.500mol | C. | 0.275mol | D. | 0.250mol |
| 实验事实 | 结论 | |
| ① | 铜生的锈是绿色的称为铜绿 | 铜绿是致密的氧化膜 |
| ② | 浓硫酸可除去烧瓶内残留的MnO2,稀硝酸可除去试管内壁的银镜,用磨口玻璃瓶保存NaOH溶液 | 都发生了氧化还原反应 |
| ③ | 少量CO2通入Na[Al(OH)4]溶液产生白色沉淀和Na2CO3 | 酸性:HCO3->Al(OH)3 |
| ④ | 某溶液加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体,该溶液滴加CaCl2溶液,有白色沉淀现象 | 确定该溶液存在CO${\;}_{3}^{2-}$ |
| ⑤ | 某无色溶液中加入浓氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该溶液一定有NH${\;}_{4}^{-}$ |
| A. | ②③⑤ | B. | ①②③ | C. | ③④⑤ | D. | 全部 |
| A. | 危险化学品危害人类健康,应禁止生产 | |
| B. | 金属钠可以保存在石蜡油中,并贴上 标志 标志 | |
| C. | 可以用大量水扑灭爆炸引发的大火 | |
| D. | 硝酸铵、氰化钠、电石和金属钠均属于电解质 |
| A. | 向饱和Na2CO3溶液中通入过量CO2 | |
| B. | 向Fe(OH)3胶体中逐滴滴加入过量H2SO4溶液 | |
| C. | 向石灰水中通入过量CO2 | |
| D. | 向NaAlO2溶液中逐滴加入盐酸至过量 |
| A. | 1mol的铁和铝的混合物与足量氯气完全反应时转移的电子数为3NA | |
| B. | 常温常压下,46g NO2和N2O4混合气体中含有的原子总数为3NA | |
| C. | 过氧化钠与水反应时,生成1molO2转移的电子数为4NA | |
| D. | 铝跟氢氧化钠溶液反应,生成3.36LH2,转移的电子数为0.3NA |
| A. | 乙酸乙酯 | B. | 甲烷 | C. | 乙酸 | D. | 植物油 |
(1)已知C(s)+H2O(g)?CO(g)+H2(g),则该反应的平衡常数表达式为$\frac{{C({H_2})C(CO)}}{{C({H_2}O)}}$.
(2)已知在一定温度下,
C(s)+CO2(g)?2CO(g)△H1
CO(g)+H2O(g)?H2(g)+CO2(g)△H2
C(s)+H2O(g)?CO(g)+H2(g)△H3
则△H1、△H2、△H3之间的关系是:△H1+△H2=△H3.
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
则该反应的正反应方向是放热反应(填“吸热”或“放热”),在500℃时,若设起始时CO和H2O的起始浓度均为0.020mol/L,则CO的平衡转化率为75%.
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等.对反应N2O4(g)?2NO2(g)△H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是D:
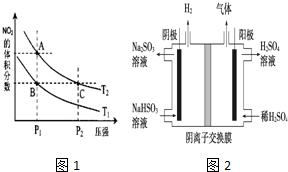
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态A到状态B,可以用加热的方法
E.A、C两点的化学平衡常数:A=C
(5)工业上用Na2SO3吸收尾气中的SO2,再用右图装置电解(惰性电极)NaHSO3制取H2SO4(阴离子交换膜只永许阴离子通过),阳极电极反应式为:4OH--4e-=2H2O+O2↑.
 以下均为中学化学常见物质,存在如下转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H.
以下均为中学化学常见物质,存在如下转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H. ;
;