题目内容
19.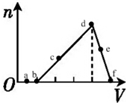 向一定物质的量浓度的AlCl3和盐酸的混合溶液中逐滴滴入NaOH溶液,生成Al(OH)3的物质的量随NaOH加入量的变化关系如图所示.则下列物质在对应的溶液中一定能大量存在的是( )
向一定物质的量浓度的AlCl3和盐酸的混合溶液中逐滴滴入NaOH溶液,生成Al(OH)3的物质的量随NaOH加入量的变化关系如图所示.则下列物质在对应的溶液中一定能大量存在的是( )| A. | a点对应的溶液中:Na+、Fe3+、SO42-、HCO3- | |
| B. | c点对应的溶液中:Na+、AlO2-、SO42-、NO3- | |
| C. | d点对应的溶液中:Ag+、Ca2+、NO3-、Cl- | |
| D. | f点对应的溶液中:K+、OH-、I-、CO32- |
分析 首先发生NaOH+HCl═NaCl+H2O,盐酸反应完毕,再发生反应3NaOH+AlCl3=3NaCl+Al(OH)3↓,最后发生NaOH+Al(OH)3=NaAlO2+2H2O,沉淀溶解.故a点溶液中有H+、Cl-、Al3+、Na+;b点溶液中有Cl-、Al3+、Na+;c点溶液中有Cl-、Al3+、Na+;d点溶液中有Cl-、Na+;e点的溶液中有Cl-、Na+、AlO2-;f点溶液中有Cl-、Na+、AlO2-,据此进行分析.
解答 解:A、a点溶液中有H+、Al3+,故HCO3-不能存在,故A错误;
B、由于c点溶液中有Al3+,能与AlO2-发生双水解,故不能共存,故B错误;
C、d点溶液中有Cl-,能与Ag+生成沉淀而不能共存,故C错误;
D、f点溶液中有Cl-、Na+、AlO2-,与K+、OH-、I-均不反应,可以共存,故D正确.
故选D.
点评 本题以图象形式考查混合物的反应的先后顺序和离子共存,清楚各阶段发生的反应是关键,题目难度不大.

练习册系列答案
相关题目
13.对金属铝的生产、氯碱工业和金属钠的生产的三个工业生产的描述正确的是( )
| A. | 电解法制铝时一般是用熔融的氧化铝进行电解,但也可用相应的盐,如熔融态的氧化铝 | |
| B. | 电解法生产铝时,需对铝土矿进行提纯,在提纯过程中应用了氧化铝或氢氧化铝的两性 | |
| C. | 在氯碱工业中,电解池中的阳极产生的是Na0H和H2 | |
| D. | 氯碱工业和金属钠的生产中都用到了NaCl,在电解时它们的阴极都是Cl-失电子 |
10.0.96g Mg跟含6.3g HNO3的稀溶液恰好反应完全,则HNO3的还原产物的摩尔质量可能是( )
| A. | 30 g•mol-1或46 g•mol-1 | B. | 44 g•mol-1或80 g•mol-1 | ||
| C. | 28 g•mol-1 | D. | 46 g•mol-1 |
14.已知燃烧7.80乙炔气体生成二氧化碳气体和液态水时,放出389.9KJ热量,则下列有关乙炔气体燃烧的热化学方程式中,正确的是( )
| A. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H═-2599.2 kJ•mol-1 | |
| B. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H═-389.9 kJ•mol-1 | |
| C. | C2H2(g)+5/2 O2(g)═2CO2(g)+H2O(l)△H═-1299.6 kJ•mol-1 | |
| D. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(g)△H═-1299.6kJ•mol-1 |
4.下列各组离子能在溶液中大量共存的是( )
| A. | H+、Ca2+、NO3-、CO32- | B. | Fe3+、K+、OH-、SO42- | ||
| C. | Ag+、Na+、Cl-、K+ | D. | K+、Na+、Cl-、NO3- |
11.已知热化学方程式:aX(g)+3Y(s)?bZ(g)△H<0.现在2L的密闭容器中加入0.9mol的X和1mol的Y,当Y的物质的量减少0.75mol时,达到平衡状态,此时X、Z的浓度分别是0.2mol/L和0.5mol/L,该温度下的平衡常数为( )
| A. | $\frac{25}{16}$ | B. | $\frac{5}{4}$ | C. | 35 | D. | 20 |
8.下列物质混合时,既能生成沉淀,又能产生气体的一组是( )
| A. | 碳酸钠和稀盐酸 | B. | 金属钠和硫酸铜溶液 | ||
| C. | 金属镁和硫酸铜溶液 | D. | 铝粉和氢氧化钠溶液 |
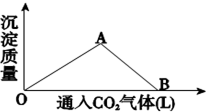 如图为一定量饱和 Ca(OH)2溶液中通入二氧化碳气体后,产生 CaCO3 白色沉淀的质量与二氧化碳体积之间的关系曲线.
如图为一定量饱和 Ca(OH)2溶液中通入二氧化碳气体后,产生 CaCO3 白色沉淀的质量与二氧化碳体积之间的关系曲线.