题目内容
【题目】聚合氯化铝是一种新型净水剂,其中铝的总浓度(用c表示)包括三类:主要为A l3+的单体形态铝(用Ala表示)总浓度,主要为主要为[AlO4 Al12(OH)24(H2O)12 ]7+的中等聚合形态铝总浓度(用Alb 表示)和Al(OH)3胶体形态铝(用A1c表示)总浓度。
(1)真空碳热还原一氧化法可实现由铝土矿制备金属铝,相关反应的热化学方程式如下:
①Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g)△H1=akJ·mol-1
②3AlCl(g)= 2Al(s)+AlCl3(g) △H2=bkJ·mol-1
则反应Al2O3(s)+33C(s)= 2Al(s)+ 3CO(g)△H=______kJ·mol-1(用含a、b的代数式表尔)。 反应①在常压、1900 ℃ 的高温下才能进行,说明△H______( 填“>”“=”或“<”)。
(1)用膜蒸馏(简称MD)浓缩技术将聚合氯化铝溶液进行浓缩,实验过程中不同浓度聚合氯化铝溶液中铝形态分布(百分数)如下表:
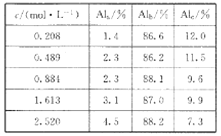
①在一定温度下,c越大,Al(OH)3胶体的百分含量______(填“越大”“越小”或“不变”)。
②若将c=2.520mol/L的聚合氯化铝溶液加水稀释,则稀释过程中发生的主要反应的离子方程式为_____________。
(3)一定条件下,向1.0mol/L的AlCl3溶液中加入0.6 mol/L的NaOH溶液,可制得Alb含量约为86 % 的聚合氯化铝溶液。写出生成[AlO4 Al12(OH)24(H2O)12 ]7+的离子方程式:_______。
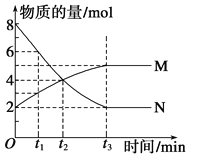
(4)已知Al3++4X=2![]() ,X表示显色剂,
,X表示显色剂, ![]() 表示有色物质,通过比色分析得到25 ℃时Al3+浓度随时间的变化关系如图所示(初始时X的浓度为0.194mol·L-1)。
表示有色物质,通过比色分析得到25 ℃时Al3+浓度随时间的变化关系如图所示(初始时X的浓度为0.194mol·L-1)。

①1min时, ![]() 的浓度为___________。
的浓度为___________。
②0~3min内该反应的速率vx=________。
③第9min时,反应达到平衡,K=__________(用代数式表示)。
【答案】 a+b > 越小 Al3++3H2O===Al(OH)3(胶体)+3H+ 13Al3++32OH-+8H2O=[AlO4Al12(OH)24(H2O)12]7+ 0.04mol/L 0.053mol/(L·min) 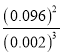
【解析】(1)已知:①Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g)△H1=akJ·mol-1,②3AlCl(g)= 2Al(s)+AlCl3(g) △H2=bkJ·mol-1,根据盖斯定律,①+②可得:Al2O3(s)+3C(s)= 2Al(s)+ 3CO(g),则△H=△H1+△H2=(a+b)kJ/mol;该反应△S>0,反应①常压下在1900℃的高温下才能进行,△H-T△S<0反应自发进行,说明该反应△H>0;(2)①根据表中数据可知在一定温度下,c越大,Alc%越小;②根据表中数据如将c=2.520molL-1的聚合氯化铝溶液加水稀释,则稀释过程中会产生氢氧化铝胶体,因此主要发生反应的离子方程式Al3++3H2OAl(OH)3(胶体)+3H+;(3)根据原子守恒和电荷守恒可知生成[AlO4 Al12(OH)24(H2O)12 ]7+的离子方程式为13Al3++32OH-+8H2O=[AlO4Al12(OH)24(H2O)12]7+;(4)①铝离子的起始浓度是0.05mol/L,1min时变为0.03mol/L,则参加反应的铝离子浓度是0.02mol/L,所以根据方程式可知1min时, ![]() 的浓度为0.02mol/L×2=0.04mol/L;②0~3min内消耗铝离子是0.05mol/L-0.01mol/L=0.04mol/L,则根据方程式可知消耗X是0.04mol/L×4=0.16mol/L,所以该反应的速率vx=0.16mol/L÷3min=0.053mol/(L·min);③根据图像可知第9min时铝离子浓度是0.002mol/L,消耗铝离子是0.05mol/L-0.002mol/L=0.048mol/L,则根据方程式可知消耗X是0.048mol/L×4=0.192mol/L,平衡时X浓度是0.194mol/L-0.192mol/L=0.002mol/L,
的浓度为0.02mol/L×2=0.04mol/L;②0~3min内消耗铝离子是0.05mol/L-0.01mol/L=0.04mol/L,则根据方程式可知消耗X是0.04mol/L×4=0.16mol/L,所以该反应的速率vx=0.16mol/L÷3min=0.053mol/(L·min);③根据图像可知第9min时铝离子浓度是0.002mol/L,消耗铝离子是0.05mol/L-0.002mol/L=0.048mol/L,则根据方程式可知消耗X是0.048mol/L×4=0.192mol/L,平衡时X浓度是0.194mol/L-0.192mol/L=0.002mol/L, ![]() 的浓度为0.048mol/L×2=0.096mol/L,所以反应达到平衡,K=
的浓度为0.048mol/L×2=0.096mol/L,所以反应达到平衡,K=![]() 。
。

【题目】下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,回答问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)表中用于半导体材料的元素在周期表中的位置是__________________。
(2)③、④、⑧的原子半径最小是___________________(用元素符号回答)。
(3)⑤、⑥、⑦的最高价氧化物对应的水化物,碱性最强的是__________(用化学式回答)。
(4)②、③、④的气态氢化物,稳定性最强的是__________(用结构式回答
(5)②和③按原子数1:2形成的化合物的电子式为____________,该晶体气化的过程中克
服的微粒间作用力为_______________________。
(6)③和⑧形成的化合物属于_______________(填“离子化合物”或“共价化合物”),该晶体属于________晶体(填“离子”、“分子”、“原子”)。
(7)元素⑤、⑦的最高价氧化物的水化物互相反应的化学方程式为:___________________。