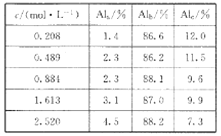
题目内容
【题目】
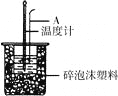
(1)烧杯间填满泡沫塑料的作用是 ;
(2)大烧杯上若不盖硬纸板,求得的中和热数值 (填“偏大”、 “偏小”、“无影响”)
(3)如下图所示,仪器A的名称是_______________;在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的△H -57.3KJ/mol(填“>”、“<”或“=”);
(4)实验中改用80mL 0.50mol/L盐酸跟100mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、“不相等”),
所求中和热 (填“相等、“不相等”) 。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(均填“偏大”、“偏小”、“无影响”)
(6)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式 ;
【答案】(1)保温防止热量损失。 (2)偏小 (3)环形玻璃棒;△H>-57.3KJ/mol
(4)不相等、相等 (5)偏小
(6)1/2H2SO4(aq)+NaOH(aq)=1/2Na2SO4(aq)+H2O(l);△H=-57.3KJ/mol
【解析】(1)在实验中应该尽可能的减少热量的损失,所以烧杯间填满泡沫塑料的作用是保温防止热量损失。
(2)大烧杯上若不盖硬纸板,则会造成热量的损失,测定结果偏低。
(3)根据仪器的结构可知,应该是是环形玻璃棒。由于酸能和氢氧化钠反应放出热量,所以造成氢氧化钠溶液的起始温度高,因此导致最终放出的热量偏少,则△H>-57.3KJ/mol。
(4)改变酸和碱的用量,反应中放出的热量会变化,但反应热是不变的,因为中和热是指酸跟碱发生中和反应生成1摩尔H2O时所放出的热量,与酸碱的用量无关。
(5)氨水是弱电解质,存在电离平衡,电离吸热,所以测得的中和热的数值偏小。
(6)根据中和热的概念可知,热化学方程式为1/2H2SO4(aq)+NaOH(aq)=1/2Na2SO4(aq)+H2O(l);△H=-57.3KJ/mol。

 阅读快车系列答案
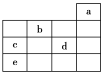
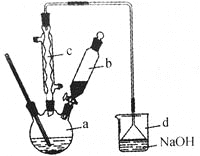
阅读快车系列答案【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
苯 | 溴 | 溴苯 | |
密度/g﹒cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑,在b中小心加入4.0mL液态溴,向a中滴入几滴溴,有白色烟雾产生,是因为生成了 气体。继续滴加至液溴滴完,装置d的作用是 ;
(2)液溴滴完后,经过下列步骤分析提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤,NaOH溶液洗涤的作用是 ;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为 ,要进一步提纯,下列操作中必须要做的是 (填入正确操作前的字母)
A.重结晶 B.过滤 C.蒸馏 D.萃取