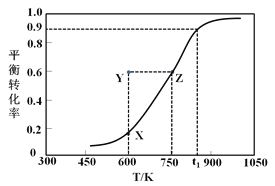
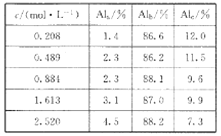
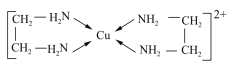
题目内容
【题目】已知3.6 g碳在 6.4 g氧气中燃烧,至反应物耗尽,共放出X kJ热量。已知单质碳的燃烧热为Y kJ/mol,则1 mol C与O2反应生成CO的反应热ΔH为
A.-Y kJ/mol B.-(5X-0.5Y) kJ/mol
C.-(10X-Y) kJ/mol D.+(10X-Y)kJ/mol
【答案】B
【解析】
试题分析:3.6g碳的物质的量是0.3mol,6.4g氧气的物质的量是0.2mol,根据反应方程式C+O2![]() CO2、2C+O2
CO2、2C+O2![]() 2CO,设生成CO2 xmol,生成CO ymol,列方程x+y=0.3、x+0.5y=0.2,解得x=0.1,y=0.2,可知生成0.1molCO2,0.2molCO。其中生成CO2放出的热量是0.1Y kJ,所以生成0.2molCO放出的热量是(X-0.1Y)kJ,生成2molCO放出的热量是(10X-Y)kJ,则C与1mol O2反应生成CO时的反应热ΔH为-(5X-0.5Y) kJ/mol,答案选B。
2CO,设生成CO2 xmol,生成CO ymol,列方程x+y=0.3、x+0.5y=0.2,解得x=0.1,y=0.2,可知生成0.1molCO2,0.2molCO。其中生成CO2放出的热量是0.1Y kJ,所以生成0.2molCO放出的热量是(X-0.1Y)kJ,生成2molCO放出的热量是(10X-Y)kJ,则C与1mol O2反应生成CO时的反应热ΔH为-(5X-0.5Y) kJ/mol,答案选B。

【题目】(11分)在2L密闭容器内,800℃时反应:2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)达平衡的时间是 ,理由是 。
(2)右图中表示NO2的变化的曲线是 。用O2表示从0~2 s内该反应的平均速率v= 。
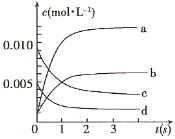
(3)能说明该反应已达到平衡状态的是 。
a.v(NO2) = 2v(O2) b.容器内各物质的浓度保持不变
c.v逆(NO) = 2v正(O2) d.达到化学平衡时,NO将完全转化为NO2
(4)能增大该反应的反应速率是 。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂