题目内容
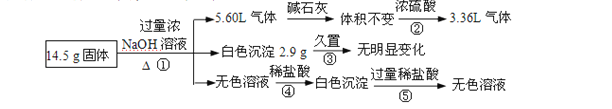
【题目】某固体混合物可能由Al、( NH4)2SO4、MgCl2、FeCl2、AlCl3中的两种或多种组成,现对该混合物做如下实验,现象和有关数据如图所示(气体体积数据换算成标准状况)。关于该固体混合物,下列说法正确的是( )
A.含有4.5gAl
B.不含FeCl2、AlCl3
C.含有物质的量相等的( NH4)2SO4和MgCl2
D.含有MgCl2、FeCl2
【答案】C
【解析】
5.60L标况下的气体通过浓硫酸后,体积变为3.36L,则表明V(H2)=3.36L,V(NH3)=2.24L,从而求出n(H2)=0.15mol,n(NH3)=0.1mol,从而确定混合物中含有Al、( NH4)2SO4;由白色沉淀久置不变色,可得出此沉淀为Mg(OH)2,物质的量为![]() ;由无色溶液中加入少量盐酸,可得白色沉淀,加入过量盐酸,白色沉淀溶解,可确定此沉淀为Al(OH)3,溶液中含有AlCl3。从而确定混合物中一定含有Al、( NH4)2SO4、MgCl2、AlCl3,一定不含有FeCl2。
;由无色溶液中加入少量盐酸,可得白色沉淀,加入过量盐酸,白色沉淀溶解,可确定此沉淀为Al(OH)3,溶液中含有AlCl3。从而确定混合物中一定含有Al、( NH4)2SO4、MgCl2、AlCl3,一定不含有FeCl2。
A. 由前面计算可知,2Al—3H2,n(H2)=0.15mol,n(Al)=0.1mol,质量为2.7g,A错误;
B. 从前面的推断中可确定,混合物中不含FeCl2,但含有AlCl3,B错误;
C. n(NH3)=0.1mol,n[(NH4)2SO4]=0.05mol,n(MgCl2)= n[Mg(OH)2]=0.05mol,从而得出(NH4)2SO4和MgCl2物质的量相等,C正确;
D. 混合物中含有MgCl2,但不含有FeCl2,D错误。
故选C。

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案
相关题目