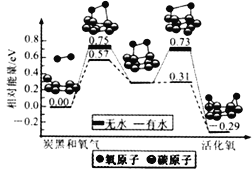
题目内容
【题目】在体积为1L的密闭容器中(体积不变)充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。下列说法正确的是( )
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。下列说法正确的是( )

A.进行到3分钟时,正反应速率和逆反应速率相等
B.10分钟后容器中各物质浓度不再改变
C.达到平衡后,升高温度,正反应速率增大、逆反应速率减小
D.10min内用H2的浓度变化表示的平均反应速率为0.075mol/(L·s)
【答案】B
【解析】
A. 正反应速率和逆反应速率相等,是指相同时间内物质浓度变化量相同,而根据图象可知进行到3分钟时,CO2和CH3OH的浓度相同,不能判断浓度变化量是否相同,故A错误;
B. 由图像知 10分钟后,达到平衡状态,容器中各物质浓度不再改变,故B正确;
C. 升高温度正逆反应速率均加快,故C错误;
D. 由图可知,10min到达平衡时二氧化碳的浓度变化量为1mol/L0.25mol/L=0.75mol/L,所以v(CO2)=0.75mol/L/10min=0.075mol/(Lmin),速率之比等于化学计量数之比,所以v(H2)=3v(CO2)=3×0.075mol/(Lmin)=0.225mol/(Lmin)=0.00375mol/(Ls),故D错误;
故选B。

 名校课堂系列答案
名校课堂系列答案【题目】滴定法是化学上常用的定量分析的方法,滴定的方法有酸碱中和滴定、氧化还原滴定、沉淀滴定、络合滴定等。
Ⅰ.甲化学兴趣小组取20.00 mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用0.200 0 mol·L-1的标准NaOH溶液进行滴定,重复上述滴定操作3次,并记录数据。
(1)滴定时边滴边摇动锥形瓶,眼睛应观察________。(填标号)
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(2)判断滴定终点的现象是_________________。
(3)根据表中数据,计算待测盐酸溶液的浓度为________ mol·L-1。
滴定次数 | 待测液体积(mL) | 标准NaOH溶液读数记录(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 4.00 | 24.00 |
第三次 | 20.00 | 2.00 | 24.10 |
Ⅱ.乙化学兴趣小组利用氧化还原反应滴定,测定了某工厂废水中游离态氯的含量。实验如下:
①取水样10.0 mL于锥形瓶中,加入10.0 mL的KI溶液(足量),滴入指示剂2~3滴。
②将自己配制的0.01 mol·L-1标准Na2S2O3溶液装入滴定管中,调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6,试回答下列问题:
(4)步骤①发生的化学反应方程式为__________;加入的指示剂是____________。
(5)步骤②应使用________式滴定管。
(6)氯的所测浓度比实际浓度会偏大,造成误差的原因可能是________。(填标号)
A.配制标准Na2S2O3溶液定容时,加水超过刻度线
B.锥形瓶水洗后直接装待测水样
C.装标准Na2S2O3溶液的滴定管水洗后没有润洗
D.滴定到达终点时,俯视读出滴定管读数
E.滴定前尖嘴部分有气泡,滴定后消失