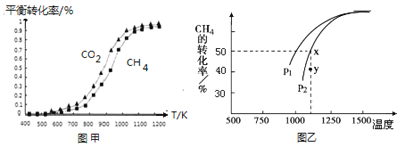
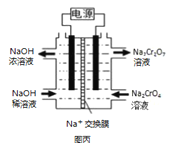
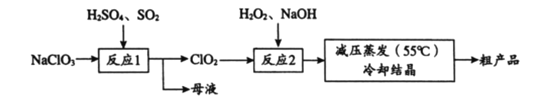
题目内容
【题目】(1)25℃时,0.1mol L-1NaOH溶液中,Kw=__;pH=__。
(2)氯化铁水溶液呈___(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):__。实验室在配制氯化铁溶液时,常将氯化铁固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,是为了___(填“促进”、“抑制”)氯化铁水解。
(3)25℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈__(填“酸性”,“中性”或“碱性”),溶液中c(Na+ )___c(CH3COO-)(填“>”,“=”或“<”)。
【答案】1.0×10-14 13 酸性 Fe3+ +3H2O![]() Fe(OH)3 +3H+ 抑制 酸性 <
Fe(OH)3 +3H+ 抑制 酸性 <
【解析】
(1)根据Kw的影响因素进行判断,pH=-lg(H+)进行计算;
(2)FeCl3是强酸弱碱盐,铁离子水解而导致其溶液呈酸性;为防止氯化铁水解,在配制氯化铁溶液时,常将FeCl3固体先溶于较浓的盐酸中,抑制其水解。
(3)醋酸为弱电解质,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合,醋酸过量,溶液呈酸性。
(1)25℃时任何水溶液的Kw都为1.0×10-14,0.1mol L-1NaOH溶液中c(OH-)=0.1mol/L,c(H+)=![]() 1.0×10-13mol/L,PH=-lg(H+)=13,
1.0×10-13mol/L,PH=-lg(H+)=13,
故答案为:1.0×10-14 ; 13;
(2)FeCl3是强酸弱碱盐,铁离子水解而导致其溶液呈酸性,水解离子方程式为Fe3+ +3H2O![]() Fe(OH)3 +3H+;在配制氯化铁溶液时,常将FeCl3固体先溶于较浓的盐酸中,从而抑制氯化铁水解,
Fe(OH)3 +3H+;在配制氯化铁溶液时,常将FeCl3固体先溶于较浓的盐酸中,从而抑制氯化铁水解,
故答案为:酸;Fe3+ +3H2O![]() Fe(OH)3 +3H+;抑制;
Fe(OH)3 +3H+;抑制;
(3)醋酸为弱电解质,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合,醋酸过量,溶液呈酸性,则c(H+)>c(OH),溶液中存在:c(CH3COO)+c(OH)=c(Na+)+c(H+),则c(Na+)<c(CH3COO),
故答案为:酸性; <。