Ő‚ńŅńŕ»›
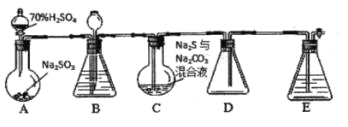
°ĺŐ‚ńŅ°Ņ25°ś Ī£¨ŌÚ20.00mL0.100molL-1ĶńįĪňģļÕī◊ňŠÔß»‹“ļ÷–∑÷ĪūĶőľ”0.100molL-1Ķń—őňŠ»‹“ļ£¨»‹“ļpHňśľ”»Ž—őňŠŐŚĽżĶńĪšĽĮ»ÁÕľňý ĺ°£Ō¬Ń–ňĶ∑®≤Ľ’ż»∑Ķń «£® £©
A.25°ś Ī£¨Kb£®NH3H2O£©£ĹKa£®CH3COOH£©°÷10-5
B.bĶ„»‹“ļ÷–ňģĶńĶÁņŽ≥Ő∂»Ī»cĶ„»‹“ļ÷–Ķńīů
C.‘ŕcĶ„Ķń»‹“ļ÷–£ļc£®Cl©Ā£©£ĺc£®CH3COOH£©£ĺc£®NH4+£©£ĺc£®OH©Ā£©
D.‘ŕaĶ„Ķń»‹“ļ÷–£ļc£®NH4+£©+2c£®H+£©®T2c£®CH3COO-£©+c£®NH3H2O£©+2c£®OH-£©
°ĺīūįł°ŅC
°ĺĹ‚őŲ°Ņ
A.łýĺ›ÕľŌůŅ…÷™£¨0.100molL©Ā1ĶńįĪňģĶńpH=11£¨c£®OH©Ā£©=10©Ā3mol/L£¨Kb£®NH3H2O£©=![]() =10©Ā5£¨ī◊ňŠÔß»‹“ļĶńpH=7£¨ňĶ√ųÔßłýņŽ◊”ļÕī◊ňŠĶńňģĹ‚≥Ő∂»ŌŗĶ»£¨‘Ú∂Ģ’ŖĶńĶÁņŽ∆Ĺļ‚≥£ żŌŗĶ»£¨ľī25°ś Ī£¨Kb£®NH3H2O£©=Ka£®CH3COOH£©°÷10©Ā5£¨Ļ A’ż»∑£Ľ
=10©Ā5£¨ī◊ňŠÔß»‹“ļĶńpH=7£¨ňĶ√ųÔßłýņŽ◊”ļÕī◊ňŠĶńňģĹ‚≥Ő∂»ŌŗĶ»£¨‘Ú∂Ģ’ŖĶńĶÁņŽ∆Ĺļ‚≥£ żŌŗĶ»£¨ľī25°ś Ī£¨Kb£®NH3H2O£©=Ka£®CH3COOH£©°÷10©Ā5£¨Ļ A’ż»∑£Ľ
B.ľ”»Ž20mLĶ»Ň®∂»ĶńHCl»‹“ļļů£¨įĪňģ«°ļ√∑ī”¶…ķ≥…¬»ĽĮÔߣ¨bĶ„ÔßłýņŽ◊”ňģĹ‚īŔĹÝŃňňģĶńĶÁņŽ£¨∂ÝcĶ„»‹÷ ő™ī◊ňŠļÕ¬»ĽĮÔߣ¨ī◊ňŠĶÁņŽ≥ŲĶń«‚ņŽ◊” Ļ»‹“ļ≥ ňŠ–‘£¨“÷÷∆ŃňňģĶńĶÁņŽ£¨‘ÚbĶ„»‹“ļ÷–ňģĶńĶÁņŽ≥Ő∂»Ī»cĶ„»‹“ļ÷–Ķńīů£¨Ļ B’ż»∑£Ľ
C.Kb£®NH3H2O£©=Ka£®CH3COOH£©°÷10©Ā5£¨Kh£®NH4+£©=![]() °÷10©Ā9£ľ10©Ā5£¨ī◊ňŠĶńĶÁņŽ≥Ő∂»ĹŌīů£¨‘Úc£®NH4+£©£ĺc£®CH3COOH£©£¨’ż»∑ĶńņŽ◊”Ň®∂»īů–°ő™£ļc£®Cl©Ā£©£ĺc£®NH4+£©£ĺc£®CH3COOH£©£ĺc£®OH©Ā£©£¨Ļ CīŪőů£Ľ
°÷10©Ā9£ľ10©Ā5£¨ī◊ňŠĶńĶÁņŽ≥Ő∂»ĹŌīů£¨‘Úc£®NH4+£©£ĺc£®CH3COOH£©£¨’ż»∑ĶńņŽ◊”Ň®∂»īů–°ő™£ļc£®Cl©Ā£©£ĺc£®NH4+£©£ĺc£®CH3COOH£©£ĺc£®OH©Ā£©£¨Ļ CīŪőů£Ľ
D.‘ŕaĶ„Ķń»‹“ļ÷–∑ī”¶ļů»‹÷ ő™Ķ»Ň®∂»ĶńCH3COONH4°ĘNH4ClļÕCH3COOH£¨łýĺ›ĶÁļ… ōļ„Ņ…÷™£ļc£®NH4+£©+c£®H+£©®Tc£®CH3COO©Ā£©+c£®Cl©Ā£©+c£®OH©Ā£©£¨łýĺ›őÔŃŌ ōļ„Ņ…Ķ√£ļ2c£®Cl©Ā£©=c£®NH4+£©+c£®NH3H2O£©£¨∂Ģ’ŖĹŠļŌŅ…Ķ√£ļc£®NH4+£©+2c£®H+£©®T2c£®CH3COO©Ā£©+c£®NH3H2O£©+2c£®OH©Ā£©£¨Ļ D’ż»∑°£
Ļ —°C°£

 53ŐžŐžŃ∑ŌĶŃ–īūįł
53ŐžŐžŃ∑ŌĶŃ–īūįł°ĺŐ‚ńŅ°Ņľ◊°Ę““◊ťÕ¨—ß∑÷Īū◊ŲŃň“‘Ō¬ŐĹĺŅ Ķ—ť°£
(1)ľ◊◊ťŐĹĺŅ![]() ”Ž
”Ž![]() »‹“ļ∑ī”¶£¨ Ķ—ť◊į÷√»ÁŌ¬£ļ
»‹“ļ∑ī”¶£¨ Ķ—ť◊į÷√»ÁŌ¬£ļ

ĘŔ«Ž÷ł≥Ųł√◊į÷√Ķń≤Ľ◊„÷ģī¶ ______ °Ę ______ °£
Ęŕ![]() ”Ž
”Ž![]() »‹“ļ∑ī”¶ĶńņŽ◊”∑Ĺ≥Ő Ĺő™ ______ °£
»‹“ļ∑ī”¶ĶńņŽ◊”∑Ĺ≥Ő Ĺő™ ______ °£
ĘŘ…Ťľ∆ Ķ—ť£¨ľÚ Ų Ķ—ť≤Ĺ÷Ť£¨÷§√ųŌī∆Ý∆Ņ÷–Ķń![]() “—ĪĽ—űĽĮ ______ °£
“—ĪĽ—űĽĮ ______ °£
(2)““◊ťŐĹĺŅ““ňŠ““ű•![]() ∑–Ķ„
∑–Ķ„![]() ‘ŕ≤ĽÕ¨ő¬∂»°Ę≤ĽÕ¨Ň®∂»NaOH»‹“ļ÷–ĶńňģĹ‚ňŔ¬ °£»°ňń÷ßīů–°ŌŗÕ¨Ķń ‘Ļ‹£¨‘ŕ ‘Ļ‹Õ‚ĪŕŐý…ŌŐŚĽżŅŐ∂»÷Ĺ£¨įīŌ¬ĪŪĹÝ––∂‘’’ Ķ—ť°£‘ŕŃĹ÷÷≤ĽÕ¨ő¬∂»Ķńňģ‘°÷–ľ”»»ŌŗÕ¨ Īľšļů£¨ľ«¬ľű•≤„ĶńŐŚĽżņī»∑∂®ňģĹ‚∑ī”¶ĶńňŔ¬
‘ŕ≤ĽÕ¨ő¬∂»°Ę≤ĽÕ¨Ň®∂»NaOH»‹“ļ÷–ĶńňģĹ‚ňŔ¬ °£»°ňń÷ßīů–°ŌŗÕ¨Ķń ‘Ļ‹£¨‘ŕ ‘Ļ‹Õ‚ĪŕŐý…ŌŐŚĽżŅŐ∂»÷Ĺ£¨įīŌ¬ĪŪĹÝ––∂‘’’ Ķ—ť°£‘ŕŃĹ÷÷≤ĽÕ¨ő¬∂»Ķńňģ‘°÷–ľ”»»ŌŗÕ¨ Īľšļů£¨ľ«¬ľű•≤„ĶńŐŚĽżņī»∑∂®ňģĹ‚∑ī”¶ĶńňŔ¬
‘Ļ‹ĘŮ | ‘Ļ‹ĘÚ | ‘Ļ‹Ęů | ‘Ļ‹ĘŰ | |
““ňŠ““ű• | 1 | V1 | V2 | V3 |
| V4 | 3 | 0 | V5 |
’ŰŃůňģ | 0 | V6 | 5 | 2 |
Ę‹«ŽÕÍ≥……ŌĪŪ£¨∆š÷–![]() ______ £¨
______ £¨![]() ______ £¨
______ £¨![]() ______ °£
______ °£
Ę› Ķ—ť÷–£¨Ņ…”√Ī•ļÕ ≥—őňģŐśīķ’ŰŃůňģ£¨∆š”ŇĶ„ « ______ £ĽĶę≤Ľń‹”√Ī•ļÕ![]() »‹“ļŐśīķ’ŰŃůňģ£¨∆š‘≠“Ú « ______ °£
»‹“ļŐśīķ’ŰŃůňģ£¨∆š‘≠“Ú « ______ °£
Ęř Ķ—ť÷–£¨ ‘Ļ‹ĘŰĪ» ‘Ļ‹ĘÚ÷–Ķńű•≤„ľű…ŔłŁŅž£¨∆š‘≠“Ú”–£ļő¬∂»łŖňŔ¬ Ņž£¨ĽĻŅ…ń‹”– ______°£