题目内容
铜在我国有色金属材料的消费中仅次于铝,广泛地应用于电气、机械制造、国防等领域。回答下列问题:
(1)铜原子基态电子排布式为 ;
(2)用晶体的x射线衍射法可以测得阿伏加德罗常数。对金属铜的测定得到以下结果:晶胞为面心立方最密堆积,边长为361 pm。又知铜的密度为9.00g·cm-3,则铜晶胞的体积是
cm3、晶胞的质量是 g,阿伏加德罗常数为 (列式计算,己知Ar(Cu)=63.6);
(3)氯和钾与不同价态的铜可生成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均为无限长链结构(如下图),a位置上Cl原子的杂化轨道类型为 。已知其中一种化合物的化学式为KCuCl3,另一种的化学式为 ;
(4)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是 ,反应的化学方应程式为 。
(1)1s22s22p63s23p63d104s1;(2)4.70×10-23;4.23×10-22;NA=63.6g.mol-1/(0.25×4.23×10-22g)=6.01×10-23;(3)sp3;K2CuCl3;(4)过氧化氢为氧化剂,氨与Cu形成配离子,两者相互促进使反应进行;Cu+H2O2+4NH3 = Cu(NH3)42+ +2OH-。
解析

三氟化氮是一种无色、无味、无毒且不可燃的气体、在半导体加工,太阳能电池和液晶显示器的制造中得到广泛应用。NF3是一种三角锥形分子,键角102°,沸点-l29℃;可在铜的催化作用下由F2和过量NH3反应得到。
(1)写出制备NF3的化学反应方程式: 。
(2)NF3的沸点比NH3的沸点(-33℃)低得多的主要原因是 。
(3)与铜属于同一周期,且未成对电子数最多的元素基态原子核外电子排布式为 。
(4)理论上HF、NaAlO2和NaCl按6:1:2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,在金属铝的冶炼中有重要作用。该物质为配合物,其中心离子是 ,配位数为 。
(5)根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1),回答下面各题:
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
①在周期表中,最可能处于同一族的是 和 。
②T元素最可能是 (填“s”“P” “d”或“ds”等)区元素,位于 族。若T为第2周期元素,F是第3周期元素中原子半径最小的元素,则T与F形成化合物的空间构型为 ,其中心原子的杂化方式为 。
下列各组物质熔点高低的比较,正确的是
| A.Al>Mg>Na | B.MgO>KCl>NaCl |
| C.晶体硅>金刚石>碳化硅 | D.AsH3>PH3>NH3 |
下面有关晶体的叙述中,不正确的是( )
| A.金刚石为空间网状结构,由共价键形成的碳原子环上,最小的环上有6个碳原子 |
| B.氯化钠晶体中,每个Na+周围距离相等的Na+共有6个 |
| C.氯化铯晶体中,每个Cs+周围紧邻8个Cl- |
| D.干冰晶体中,每个CO2分子周围紧邻12个CO2分子 |
石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如下),可由石墨剥离而成,具有极好的应用前景。下列说法正确的是( )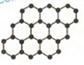
| A.石墨烯与石墨互为同位素 |
| B.0.12g石墨烯中含有6. 02×1022个碳原子 |
| C.石墨烯是一种有机物 |
| D.石墨烯中的碳原子间以共价键结合 |
下列各类物质中,固态时只能形成离子晶体的是( )。
| A.非金属氧化物 | B.非金属单质 | C.强酸 | D.强碱 |
