题目内容
【题目】二氧化锆(ZrO2)是最重要的氧离子固体电解质,用于制造燃料电池、氧气含量测定仪等。可由锆英砂(主要成分为ZrSiO4,也可表示为ZrO2·SiO2;含有少量Fe2O3、Al2O3、SiO2杂质)通过如下工艺流程法制得。
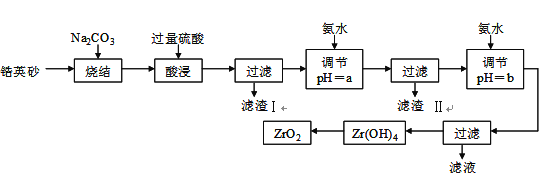
已知:①ZrO2具有两性,高温与纯碱共熔生成可溶于水的Na2ZrO3,与酸反应生成ZrO2+。②部分金属离子开始沉淀和完全沉淀的pH如下表:
金属离子 | Fe3+ | Al3+ | ZrO2+ |
开始沉淀的pH | 1.9 | 3.3 | 6.2 |
沉淀完全的pH | 3.2 | 5.2 | 8.0 |
请回答下列问题:
⑴烧结时ZrSiO4发生反应的化学方程式为_______________________;
滤渣I的化学式为______________________________。
⑵调节pH=a 的目的是________________________________________;用氨水调节pH=b后发生反应的离子方程式为______________________________________________。
⑶以滤渣II为主要原料制取铁红,请简述实验方法________________________。
⑷工业上用铝热法冶炼锆,写出以ZrO2通过铝热法制取锆的化学方程式:
________________________________________________________。
⑸一种新型燃料电池用掺杂Y2O3的ZrO2晶体作电解质在熔融状态下传导O2-,一极通入空气,另一极通入甲烷,写出负极的电极反应式为___________________________。
【答案】 ZrSiO4 + 2Na2CO3![]() Na2ZrO3 + Na2SiO3 +2CO2 ↑ H2SiO3 (或H4SiO4) 完全沉淀Fe3+、Al3+,而ZrO2+不沉淀 ZrO2+ + 2NH3·H2O + H2O=Zr(OH)4↓+2NH4+ 在滤渣II中加足量NaOH溶液充分反应,过滤、洗净、干燥、加热分解 3ZrO2 + 4Al
Na2ZrO3 + Na2SiO3 +2CO2 ↑ H2SiO3 (或H4SiO4) 完全沉淀Fe3+、Al3+,而ZrO2+不沉淀 ZrO2+ + 2NH3·H2O + H2O=Zr(OH)4↓+2NH4+ 在滤渣II中加足量NaOH溶液充分反应,过滤、洗净、干燥、加热分解 3ZrO2 + 4Al![]() 3Zr + 2Al2O3 CH4-8e-+ 4O2-=CO2 +2H2O
3Zr + 2Al2O3 CH4-8e-+ 4O2-=CO2 +2H2O
【解析】ZrSiO4也可表示为ZrO2·SiO2,高温与纯碱共熔生成可溶于水的Na2ZrO3,还会生成Na2SiO3和CO2;酸浸时Zr、Fe、Al的化合物均溶解,Si的化合物转化为H2SiO3(或H4SiO4)沉淀,过滤所得滤渣Ⅰ是H2SiO3(或H4SiO4),滤液中含有Na+、Fe+、Al+、ZrO2+等阳离子;加氨水调节pH至5.2~6.2,滤渣Ⅱ为Fe(OH)3、Al(OH)3;将滤液再次调节pH至8.0得到Zr(OH)4沉淀,最后得到纯度较高的ZrO2。
(1)根据上述分析烧结时ZrSiO4发生反应的化学方程式为:ZrSiO4 + 2Na2CO3![]() Na2ZrO3 + Na2SiO3 +2CO2 ↑;滤渣I的化学式为:H2SiO3(或H4SiO4)。
Na2ZrO3 + Na2SiO3 +2CO2 ↑;滤渣I的化学式为:H2SiO3(或H4SiO4)。
(2)流程中共有2次调节pH,则第一次调节pH是为了除去Fe3+、Al3+,而不能使ZrO2+沉淀;第二次调节pH使ZrO2+变为Zr(OH)4沉淀,离子方程式为:ZrO2+ + 2NH3·H2O + H2O=Zr(OH)4↓+2NH4+。
(3)滤渣Ⅱ为Fe(OH)3、Al(OH)3,要制取铁红需先除去Al(OH)3,再分解Fe(OH)3,故实验方法为:在滤渣Ⅱ中加足量NaOH溶液充分反应,过滤、洗净、干燥、加热分解。
(4)以ZrO2通过铝热法制取锆,利用高温下Al还原ZrO2,化学方程式为:3ZrO2 + 4Al![]() 3Zr + 2Al2O3。
3Zr + 2Al2O3。
(5)新型甲烷燃料电池传导O2-,故正极反应为:O2+4e-=2O2-,又因为总反应为:CH4+2O2=CO2 +2H2O,所以负极反应为:CH4-8e-+ 4O2-=CO2+2H2O。

【题目】某研究小组利用下图装置探究温度对CO还原Fe2O3的影响(固定装置略)。

(1)写出MgCO3分解的化学方程式__________________________。
(2)装置C的作用是__________________________,处理尾气的方法为__________。
(3)将研究小组分为两组,按上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物)。两组分别用产物进行以下实验:
步骤 | 操作 | 甲组现象 | 乙组现象 |
1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,有气泡 |
2 | 取步骤1中溶液,滴加K3[Fe(CN)6]溶液 | 蓝色沉淀 | 蓝色沉淀 |
3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
①乙组得到的黑色粉末是_________。
②甲组步骤1中反应的离子方程式为_______________________________________________。
③乙组步骤4中,溶液变红的原因为_______________________________________________。
④从实验安全考虑,题图装置还可采取的改进措施是________________________________。