题目内容
14.200℃时,11.6g CO2和水蒸气的混合气体与足量的Na2O2充分反应后固体质量增加了3.6g,则原混合气体的总物质的量是( )| A. | 0.125mol | B. | 0.25mol | C. | 0.5mol | D. | 1mol |
分析 向足量的固体Na2O2中通入11.6gCO2和H2O,发生反应:2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,固体只增加3.6g,是因为生成O2,根据质量守恒定律可知m(O2)=11.6g-3.6g=8.0g,所以n(O2)=$\frac{8g}{32g/mol}$=0.25mol,再根据反应方程式可知水和二氧化碳的物质的量为生成氧气的物质的量2倍.
解答 解:向足量的固体Na2O2中通入11.6gCO2和H2O,发生反应:2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑,
固体只增加3.6g,是因为生成O2,根据质量守恒定律可知生成氧气的质量为:m(O2)=11.6g-3.6g=8.0g,物质的量为:n(O2)=$\frac{8g}{32g/mol}$=0.25mol,
结合反应方程式可知,相互的二氧化碳、水与生成氧气的物质的量之比都为2:1,
所以原混合气体的总物质的量为生成氧气的物质的量的2倍,为:0.25mol×2=0.5mol,
故选C.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质及反应前后质量变化为解答关键,试题侧重考查学生的分析、理解能力及化学计算能力.

练习册系列答案
 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案 互动课堂系列答案
互动课堂系列答案
相关题目
4.下列有关乙酸的说法中不正确的是( )
| A. | 冰和乙酸的混合物俗称冰醋酸 | |
| B. | 具有酸的通性 | |
| C. | 酸性比碳酸的酸性强 | |
| D. | 与乙醇反应生成的有机物是乙酸乙酯 |
9.下列装置属于原电池的是( )
| A. |  CuSO4溶液 | B. | 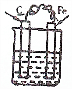 CuSO4溶液 | C. | 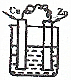 H2SO4 | D. |  酒精 |
4.下列广告对应商品中含有的化学物质正确的是( )
| A. | “莲花味精、领先(鲜)一步”--蛋白质 | |
| B. | “何以解优,唯有杜康”--乙醇 | |
| C. | “盖中盖片高钙片,吸收好”--硫酸钙 | |
| D. | “恒源祥,羊羊羊”--纤维素 |
11.下列有关物质检验的实验及结论不正确的是( )
| 选项 | 实验操作及现象 | 实验结论 |
| A | 食醋浸泡水垢产生无色气体 | 乙酸的酸性比碳酸强 |
| B | 乙醇与橙色酸性重铬酸钾溶液混合,橙色溶液变为绿色 | 乙醇具有还原性 |
| C | 用铝制容器保存浓硝酸 | 浓硝酸与铝不发生化学反应 |
| D | 碘酒滴到土豆片上变蓝 | 淀粉遇碘单质变蓝 |
| A. | A | B. | B | C. | C | D. | D |
8.下列关于有机物的说法中正确的是( )
| A. | 甲烷、一氯甲烷、二氯甲烷等均属于烷烃 | |
| B. | 油脂、蛋白质都能发生水解反应 | |
| C. | 乙酸、乙酸乙酯都不能与金属Na反应 | |
| D. | 苯不与任何酸反应 |
9.如图所示的分子酷似企鹅,化学家将该分子以企鹅来取名为Penguinone.下列有关说法正确的是( )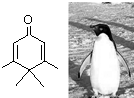

| A. | Penguinone是一种芳香烃 | |
| B. | Penguinone的分子式为C9H12O | |
| C. | Penguinone的一氯取代产物有4种 | |
| D. | 1molPenguinone最多能与3 mol H2发生加成反应 |