题目内容
2.设NA表示阿伏伽德罗常数的值,下列叙述中正确的是( )①标准状况下,11.2L乙醇完全燃烧产生的CO2的分子数为0.5NA;
②标准状况下,a L的氧气和氮气的混合物含有的分子数为$\frac{a}{22.4}$NA;
③标准状况下,等物质的量的SO2和SO3所占体积相同;
④某条件下,将1mol N2与3mol H2在密闭容器中充分反应,生成NH3的分子数为2NA;
⑤7.1g氯气与足量氢氧化钠溶液反应转移的电子数为0.1NA.
| A. | ①④ | B. | ②③ | C. | ③⑤ | D. | ②⑤ |
分析 ①标况下,乙醇为液体;
②求出混合气体的物质的量n=$\frac{V}{{V}_{m}}$,然后根据分子个数N=nNA来计算;
③标况下,三氧化硫为固体;
④合成氨的反应为可逆反应;
⑤求出氯气的物质的量,然后根据氯气与氢氧化钠的反应为歧化反应来分析.
解答 解:①标况下,乙醇为液体,不能根据气体摩尔体积来计算其物质的量,故11.2L乙醇的物质的量不能计算,则燃烧产生的二氧化碳的分子个数无法计算,故①错误;
②标况下,aL混合气体的物质的量n=$\frac{V}{{V}_{m}}$=$\frac{a}{22.4}$mol,故分子个数N=nNA=$\frac{a}{22.4}{N}_{A}$,故②正确;
③标况下,三氧化硫为固体,不能根据气体摩尔体积来计算三氧化硫的体积,即等物质的量的两者的体积不等,故③错误;
④合成氨的反应为可逆反应,故1mol N2与3mol H2在密闭容器中充分反应,生成NH3的分子数小于2NA,故④错误;
⑤7.1g氯气的物质的量为0.1mol,而氯气与氢氧化钠的反应为歧化反应,1mol氯气转移1mol电子,则0.1mol氯气转移0.1mol电子即0.1NA个,故⑤正确;
故选D.
点评 本题考查了阿伏伽德罗常数额有关计算,熟练掌握公式的运用是解题关键,难度不大.

练习册系列答案
相关题目
12.某锂电池的电池总反应为4Li+2SOCl2═4LiCl+S+SO2,下列有关说法错误的是( )
| A. | 锂电极作电池负极,放电过程中发生氧化反应 | |
| B. | 1molSOCl2发生电极反应转移的电子数为2mol | |
| C. | 电池的正极反应为2SOCl2+2e-═4Cl-+S+SO2 | |
| D. | 组装该电池必须在无水、无氧的条件下进行 |
13.下列说法中,不正确的是( )
| A. | 蛋白质的变性是不可逆的 | |
| B. | 在一定条件下,蛋白质水解的最终产物是氨基酸 | |
| C. | 为检验皂化反应进行程度,取几滴反应液,滴入装有热水的试管中,震荡,若没有油滴浮在液面上,说明油脂已完全反应 | |
| D. | 检验淀粉在稀硫酸催化下水解程度的方法是:取适量水解液于试管中,加入少量碘水,若出现蓝色说明没有水解 |
10.下列有关物质的性质与应用的对应关系正确的是( )
| A. | 铜的金属活动性比铁弱,可在海轮外壳上装若干铜块以减缓其腐蚀 | |
| B. | 硫酸铜溶于水呈酸性,可用来做杀菌剂 | |
| C. | 氧化铝熔点高,可用于生产耐火砖 | |
| D. | 明矾溶液具有强氧化性,可用作净水剂 |
7.分别将下列各物质等体积混合,在室温下剧烈振荡,静止后能形成均匀溶液的是( )
| A. | 乙酸乙酯、水 | B. | 苯、水 | C. | 乙醇、水 | D. | 四氯化碳、碘水 |
14.200℃时,11.6g CO2和水蒸气的混合气体与足量的Na2O2充分反应后固体质量增加了3.6g,则原混合气体的总物质的量是( )
| A. | 0.125mol | B. | 0.25mol | C. | 0.5mol | D. | 1mol |
16.化学与环境、能源、材料和科技等密切相关.下列说法中错误的是( )
| A. | 在家用燃煤中加入适量的生石灰能有效减少二氧化硫的排放 | |
| B. | 农村大力发展沼气,将废弃的秸秆转化为清洁高效的能源 | |
| C. | 鼓励汽车、家电“以旧换新”,可提高能源利用效率,与环境保护基本无关系 | |
| D. | 氢氧燃料电池要广泛地应用于实际生产、生活中,高容量储氢材料的研制是需解决的关键技术问题之一 |
17.下列有机物命名正确的是( )
| A. | 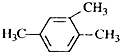 1,2,4-三甲苯 | B. | 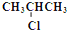 2-氯丙烷 | C. | 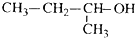 2-甲基-1-丙醇 | D. | 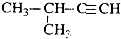 2-甲基-3-丁炔 |