题目内容
5.将0.34g Cu和CuO的混合物加入到物质的量浓度约为12mol/L的浓硫酸中,并加热使其完全溶解,然后用NaOH溶液中和过量硫酸,再用水稀释到0.5L加入纯铁粉1.85g,反应后过滤、干燥,得不溶物1.89g.求置换出的铜的质量及原混合物中铜的质量分数.分析 先根据质量差计算出加入纯铁粉1.85g后置换出的铜的质量,然后设混合物中Cu的质量为yg,再根据混合物总质量及计算出的铜元素的质量计算出混合物中铜的质量,最后计算出铜质量分数.
解答 解:设置换出的铜的质量为x,
CuSO4+Fe═FeSO4+Cu 差量△m
64 8
x (1.89g-1.85g)=0.04g
有64:x=8:0.04g,
解得:x=0.32g;
设混合物中Cu的质量为yg,则CuO为(0.34-y)g,其中含Cu[(0.34-y)×$\frac{64}{80}$]g,
则0.32=y+[(0.34-y)×$\frac{64}{80}$],
解得:y=0.24,
所以铜的质量分数为:$\frac{0.24g}{0.34g}$×100%≈70.59%,
答:置换出的铜的质量为0.32g,原混合物中铜的质量分数约为70.59%.
点评 本题考查了有关混合物的简单计算,题目难度中等,根据差量法计算出混合物中铜元素的质量是解题关键,注意掌握常见元素及其化合物的性质,能够根据反应方程式进行简单的混合物的计算.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案
相关题目
15.如图所示,甲池的总反应式O2+N2H4═2H2O+N2.有关该装置工作时,说法正确的是( )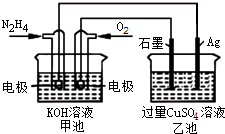

| A. | 甲池中,负极反应为N2H4-4e-═4H++N2 | |
| B. | 甲池溶液pH保持不变,乙池溶液pH减小 | |
| C. | 甲池中消耗2.24LO2,此时乙池中理论上最多产生12.8g固体 | |
| D. | 反应一段时间后,向乙池中加一定量CuO固体,能使CuSO4溶液恢复到原浓度 |
16.下列有关物质性质的说法错误的是( )
| A. | 热稳定性:HCl>HI | B. | 离子半径:Na+>O2- | ||
| C. | 酸性:HClO4>H2SO4 | D. | 还原性:S2->Cl- |
13.下列说法中,不正确的是( )
| A. | 蛋白质的变性是不可逆的 | |
| B. | 在一定条件下,蛋白质水解的最终产物是氨基酸 | |
| C. | 为检验皂化反应进行程度,取几滴反应液,滴入装有热水的试管中,震荡,若没有油滴浮在液面上,说明油脂已完全反应 | |
| D. | 检验淀粉在稀硫酸催化下水解程度的方法是:取适量水解液于试管中,加入少量碘水,若出现蓝色说明没有水解 |
20.取等物质的量的镁粉和铝粉混合,再将混合物平分为四份,分别加入足量的下列溶液中,充分反应后放出氢气最多的是( )
| A. | 3mol/L 的盐酸 | B. | 4mol/L 的硝酸 | ||
| C. | 8mol/L 的氢氧化钠溶液 | D. | 18mol/L 的硫酸 |
10.下列有关物质的性质与应用的对应关系正确的是( )
| A. | 铜的金属活动性比铁弱,可在海轮外壳上装若干铜块以减缓其腐蚀 | |
| B. | 硫酸铜溶于水呈酸性,可用来做杀菌剂 | |
| C. | 氧化铝熔点高,可用于生产耐火砖 | |
| D. | 明矾溶液具有强氧化性,可用作净水剂 |
14.200℃时,11.6g CO2和水蒸气的混合气体与足量的Na2O2充分反应后固体质量增加了3.6g,则原混合气体的总物质的量是( )
| A. | 0.125mol | B. | 0.25mol | C. | 0.5mol | D. | 1mol |
20.在相同条件下,取相同体积的下列各物质,其充分燃烧后生产二氧化碳和水的物质的量最多的是( )
| A. | C2H6 | B. | C3H6 | C. | C3H8 | D. | C2H4 |