题目内容
18.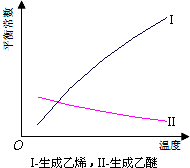 乙醇脱水反应在不同温度条件下得到的产物组成不同.表是常压、某催化剂存在条件下,分别以等量乙醇在不同温度下进行脱水实验获得的数据,每次实验反应时间均相同.
乙醇脱水反应在不同温度条件下得到的产物组成不同.表是常压、某催化剂存在条件下,分别以等量乙醇在不同温度下进行脱水实验获得的数据,每次实验反应时间均相同.| 温度(℃) | 乙醇转化率(%) | 有机产物含量(体积分数) | |
| 乙烯(%) | 乙醚(%) | ||
| 125 | 20 | 8.7 | 90.2 |
| 150 | 68 | 16.7 | 82.2 |
| 175 | 88 | 32.3 | 66.8 |
| 200 | 90 | 86.9 | 12.1 |
(1)乙醇脱水制乙烯的反应是吸热(填“放热”、“吸热”)反应,若增大压强,平衡逆向(选填“正向”、“逆向”、“不”)移动;
(2)已知:150℃时,1mol乙醇蒸汽脱水转变为1mol乙烯,反应热的数值为46KJ,写出该反应的热化学方程式C2H5OH(g)→C2H4(g)+H2O(g)△H=+46KJ/mol;
(3)写出乙醇脱水制乙醚的反应的平衡常数表达式K=$\frac{[C{\;}_{2}H{\;}_{5}OC{\;}_{2}H{\;}_{5}]•[H{\;}_{2}O]}{[C{\;}_{2}H{\;}_{5}OH]{\;}^{2}}$.当乙醇起始浓度相同时,平衡常数K值越大,表明ab(填字母).
a.乙醇的转化率越高 b.反应进行得越完全
c.达到平衡时乙醇的浓度越大 d.化学反应速率越快
(4)根据表中数据分析,150℃时乙醇催化脱水制取的乙醚产量大于(选填“大于”、“小于”、“等于”)125℃时;为了又快又多地得到产品,乙醇制乙醚合适的反应温度区域是150~175℃.
分析 (1)分解反应是吸热反应,增大压强平衡向体积减小的方向进行;
(2)根据热化学方程式的书写方法和反应特点分析;
(3)根据化学方程式进行计算,K值越大,表示该反应向正方向进行的程度越大;
(4)根据表中数据解题,选取反应的温度应考虑乙醇的转化率,和乙醚的含量.
解答 解:(1)分解反应是吸热反应,乙醇脱水制乙烯的反应是分解反应,增大压强平衡向体积减小的方向进行,故向逆反应方向进行.故答案为:吸热;逆向;
(2)1mol乙醇蒸汽脱水转变为1mol乙烯,反应热的数值为46KJ,分解反应多为吸热反应,该反应的热化学方程式为C2H5OH(g)→C2H4(g)+H2O(g)△H=+46KJ/mol,
故答案为:C2H5OH(g)→C2H4(g)+H2O(g)△H=+46KJ/mol;
(3)反应方程式为2C2H5OH$\frac{\underline{\;浓硫酸\;}}{140℃}$C2H5OC2H5+H2O,平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,K=$\frac{[C{\;}_{2}H{\;}_{5}OC{\;}_{2}H{\;}_{5}]•[H{\;}_{2}O]}{[C{\;}_{2}H{\;}_{5}OH]{\;}^{2}}$,K值越大,表示该反应向正方向进行的程度越大,乙醇的转化率越高,反应进行得越完全,故答案为:K=$\frac{[C{\;}_{2}H{\;}_{5}OC{\;}_{2}H{\;}_{5}]•[H{\;}_{2}O]}{[C{\;}_{2}H{\;}_{5}OH]{\;}^{2}}$; ab;
(4)乙醚产量应同时考虑乙醇的转化率和乙醚的含量.由表知,150℃时乙醇催化脱水制取的乙醚产量大于125℃时,乙醇制乙醚合适的反应温度区域是 150~175℃,
故答案为:大于;150~175℃.
点评 本题考查影响平衡的因素、热化学方程式书写、化学平衡常数的含义、电极反应式书写,难度适中,读懂表中数据是解题的关键.

| A. | 3:2:1 | B. | 1:2:3 | C. | 1:3:2 | D. | 2:3:1 |
| A. | HCl MgCl2 NH4Cl | B. | H2O Na2O CO2 | ||
| C. | CaCl2 ? NaOH H2O | D. | NH3 H2O CO2 |
| A. | 硅胶不可以用作食品干燥剂 | |
| B. | 五氧化二磷可以用作食品干燥剂 | |
| C. | 六水合氯化钙可以用作食品干燥剂 | |
| D. | 加工后具有吸水性的植物纤维可以用作食品干燥剂 |
| A. | CO2通入澄清的石灰水中反应的产物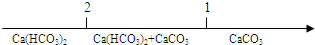 $\frac{n(C{O}_{2})}{n[Ca(OH)_{2}]}$ $\frac{n(C{O}_{2})}{n[Ca(OH)_{2}]}$ | |
| B. | Fe在Cl2中的燃烧产物: $\frac{n(C{l}_{2})}{n(Fe)}$ $\frac{n(C{l}_{2})}{n(Fe)}$ | |
| C. | AlCl3溶液中滴加NaOH后铝的存在形式: $\frac{n(NaOH)}{n(AlC{l}_{3})}$ $\frac{n(NaOH)}{n(AlC{l}_{3})}$ | |
| D. | 氨水与SO2反应后溶液中的铵盐: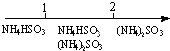 $\frac{n(N{H}_{3}{H}_{2}O)}{n(S{O}_{2})}$11 $\frac{n(N{H}_{3}{H}_{2}O)}{n(S{O}_{2})}$11 |
| A. | 双氧水中加入稀硫酸和KI溶液:H2O2+2I-+2H+═I2+2H2O | |
| B. | 电解氯化镁溶液产生黄绿色气体:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| C. | 将切开的金属Na露置在空气中,表面由光亮逐渐变暗:2Na+O2═Na2O2 | |
| D. | 向Ca(HCO3)2溶液中加入过量的烧碱溶液,出现白色沉淀:HCO3-+Ca2++OH-═CaCO3↓+H2O |
| A. | 氨气能与氯气生成氯化铵,可用浓氨水检验输送氯气的管道是否泄漏 | |
| B. | SO2有强还原性,用SO2漂白纸浆 | |
| C. | 熟石膏与水的糊状混合物会很快凝固,可用它制作模型和石膏绷带 | |
| D. | 铝有强还原性且转化为氧化铝时放出大量的热,可用铝粉来还原某些金属氧化物 |
| A. | 点燃的酒精灯不小必打碎了,可先用自来水灭火 | |
| B. | 皮肤沾上浓碱后可先用水洗后再用稀硼酸涂抹 | |
| C. | 制备蒸馏水中,为防止暴沸可将混合液加热一段时间后再加放碎瓷片 | |
| D. | 冷凝管用作冷凝回流时,为防止有机物蒸汽逸出,可使用橡胶塞封末端出口 |
| A酸 | B碱 | C盐 | D氧化物 |
| H2SO4 | Ba(OH)2 | H2S | H2O2 |
| NaHCO3 | Cu2(OH)2CO3 | KCl | CO |
| HNO3 | NaOH | CaCO3 | CuO |
| HCl | Na2CO3 | CuSO4 | MnO2 |
| A. | A | B. | B | C. | C | D. | D |