题目内容
10.下列有关物质的性质与应用不相对应的是( )| A. | 氨气能与氯气生成氯化铵,可用浓氨水检验输送氯气的管道是否泄漏 | |
| B. | SO2有强还原性,用SO2漂白纸浆 | |
| C. | 熟石膏与水的糊状混合物会很快凝固,可用它制作模型和石膏绷带 | |
| D. | 铝有强还原性且转化为氧化铝时放出大量的热,可用铝粉来还原某些金属氧化物 |
分析 A.NH3能与Cl2反应生成NH4Cl,该物质是一种白色固体物质;
B.依据二氧化硫漂白性原理;
C.熟石膏与水的糊状混合物会很快脱水凝固;
D.根据铝热反应的用途分析决定.
解答 解:A.NH3是碱性气体,可以与Cl2反应生成NH4Cl,该物质是一种白色固体物质,可根据是否冒白烟用浓氨水检验输送氯气的管道是否有泄漏,故A正确;
B.二氧化硫有漂白性,能漂白某些物质,漂白原理是与有机色素化合生成无色物质,故B错误;
C.熟石膏与水的糊状混合物会很快脱水凝固,故可以用它制作模型和医疗上的石膏绷带,故C正确;
D.铝有强还原性且转化为氧化铝时放出大量的热,可以利用该特点用铝粉来还原一些金属氧化物,制备熔点较高的金属,故D正确;
故选:B.
点评 本题考查了元素化合物知识,明确二氧化硫、氨气、硫酸钙、铝的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
13.分子式为C4H8O2能与NaOH溶液发生水解反应的有机物有(不含顺反异构)( )
| A. | 6种 | B. | 5种 | C. | 4种 | D. | 3种 |
1.高纯MnCO3是制备高性能磁性材料的主要原料.某化学小组在实验室模拟用软锰矿(主要成分MnO2,杂质为铁及铜的化合物等)制备高纯碳酸锰,过程如下(部分操作和条件略):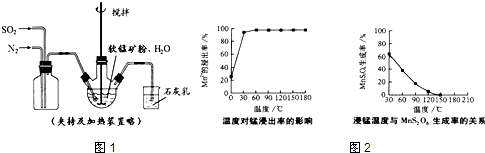
①缓慢向烧瓶中(见图1)通入过量混合气进行“浸锰”操作,主要反应原理为:SO2+H2O=H2SO3;MnO2+H2SO3=MnSO4+H2O(铁浸出后,过量的SO2会将Fe3+还原为Fe2+)
②向“浸锰”结束后的烧瓶中加入一定量纯MnO2粉末.
③再用Na2CO3溶液调节pH为3.5左右,过滤.
④调节滤液pH为6.5~7.2,加入NH4HCO3,有无色无味的气体放出,同时有浅红色的沉淀生成,经过滤、洗涤、干燥,得到高纯碳酸锰.请回答:
(1)石灰乳参与反应的化学方程式为Ca(OH)2+SO2═CaSO3+H2O.
(2)“浸锰”反应中往往有副产物MnS2O6的生成,温度对“浸锰”反应的影响如图2,为减少MnS2O6 的生成,“浸锰”过程适宜的温度是150℃(或150℃以上).
(3)查阅下表回答②中加入一定量纯MnO2粉末的主要作用是将Fe2+氧化为Fe3+,将过量的SO2氧化除去.
(4)③中所得的滤液中含有Cu2+,可添加过量的难溶电解质MnS除去Cu2+,经过滤,得到纯净的MnSO4溶液.用平衡移动原理解释加入MnS的作用MnS(S)?Mn2+(aq)+S2-(aq)、S2-(aq)+Cu2+(aq)?CuS(S)生成的CuS比MnS更难溶,促进MnS不断溶解,平衡右移,使Cu2+除去.
(5)④中加入NH4HCO3后发生反应的离子方程式是Mn2++2HCO3-=MnCO3↓+CO2↑+H2O.
(6)已知MnCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃开始分解.请问用少量C2H5OH洗涤的原因是防止MnCO3潮湿时被空气氧化、便于在温度低于100℃干燥等.

①缓慢向烧瓶中(见图1)通入过量混合气进行“浸锰”操作,主要反应原理为:SO2+H2O=H2SO3;MnO2+H2SO3=MnSO4+H2O(铁浸出后,过量的SO2会将Fe3+还原为Fe2+)
②向“浸锰”结束后的烧瓶中加入一定量纯MnO2粉末.
③再用Na2CO3溶液调节pH为3.5左右,过滤.
④调节滤液pH为6.5~7.2,加入NH4HCO3,有无色无味的气体放出,同时有浅红色的沉淀生成,经过滤、洗涤、干燥,得到高纯碳酸锰.请回答:
(1)石灰乳参与反应的化学方程式为Ca(OH)2+SO2═CaSO3+H2O.
(2)“浸锰”反应中往往有副产物MnS2O6的生成,温度对“浸锰”反应的影响如图2,为减少MnS2O6 的生成,“浸锰”过程适宜的温度是150℃(或150℃以上).
(3)查阅下表回答②中加入一定量纯MnO2粉末的主要作用是将Fe2+氧化为Fe3+,将过量的SO2氧化除去.
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 | 4.7 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 | 6.7 |
(5)④中加入NH4HCO3后发生反应的离子方程式是Mn2++2HCO3-=MnCO3↓+CO2↑+H2O.
(6)已知MnCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃开始分解.请问用少量C2H5OH洗涤的原因是防止MnCO3潮湿时被空气氧化、便于在温度低于100℃干燥等.
18.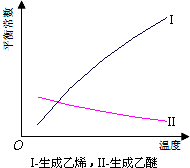 乙醇脱水反应在不同温度条件下得到的产物组成不同.表是常压、某催化剂存在条件下,分别以等量乙醇在不同温度下进行脱水实验获得的数据,每次实验反应时间均相同.
乙醇脱水反应在不同温度条件下得到的产物组成不同.表是常压、某催化剂存在条件下,分别以等量乙醇在不同温度下进行脱水实验获得的数据,每次实验反应时间均相同.
已知:乙醇和乙醚(CH3CH2OCH2CH3)的沸点分别为78.4℃和34.5℃.请回答下列问题:
(1)乙醇脱水制乙烯的反应是吸热(填“放热”、“吸热”)反应,若增大压强,平衡逆向(选填“正向”、“逆向”、“不”)移动;
(2)已知:150℃时,1mol乙醇蒸汽脱水转变为1mol乙烯,反应热的数值为46KJ,写出该反应的热化学方程式C2H5OH(g)→C2H4(g)+H2O(g)△H=+46KJ/mol;
(3)写出乙醇脱水制乙醚的反应的平衡常数表达式K=$\frac{[C{\;}_{2}H{\;}_{5}OC{\;}_{2}H{\;}_{5}]•[H{\;}_{2}O]}{[C{\;}_{2}H{\;}_{5}OH]{\;}^{2}}$.当乙醇起始浓度相同时,平衡常数K值越大,表明ab(填字母).
a.乙醇的转化率越高 b.反应进行得越完全
c.达到平衡时乙醇的浓度越大 d.化学反应速率越快
(4)根据表中数据分析,150℃时乙醇催化脱水制取的乙醚产量大于(选填“大于”、“小于”、“等于”)125℃时;为了又快又多地得到产品,乙醇制乙醚合适的反应温度区域是150~175℃.
 乙醇脱水反应在不同温度条件下得到的产物组成不同.表是常压、某催化剂存在条件下,分别以等量乙醇在不同温度下进行脱水实验获得的数据,每次实验反应时间均相同.
乙醇脱水反应在不同温度条件下得到的产物组成不同.表是常压、某催化剂存在条件下,分别以等量乙醇在不同温度下进行脱水实验获得的数据,每次实验反应时间均相同.| 温度(℃) | 乙醇转化率(%) | 有机产物含量(体积分数) | |
| 乙烯(%) | 乙醚(%) | ||
| 125 | 20 | 8.7 | 90.2 |
| 150 | 68 | 16.7 | 82.2 |
| 175 | 88 | 32.3 | 66.8 |
| 200 | 90 | 86.9 | 12.1 |
(1)乙醇脱水制乙烯的反应是吸热(填“放热”、“吸热”)反应,若增大压强,平衡逆向(选填“正向”、“逆向”、“不”)移动;
(2)已知:150℃时,1mol乙醇蒸汽脱水转变为1mol乙烯,反应热的数值为46KJ,写出该反应的热化学方程式C2H5OH(g)→C2H4(g)+H2O(g)△H=+46KJ/mol;
(3)写出乙醇脱水制乙醚的反应的平衡常数表达式K=$\frac{[C{\;}_{2}H{\;}_{5}OC{\;}_{2}H{\;}_{5}]•[H{\;}_{2}O]}{[C{\;}_{2}H{\;}_{5}OH]{\;}^{2}}$.当乙醇起始浓度相同时,平衡常数K值越大,表明ab(填字母).
a.乙醇的转化率越高 b.反应进行得越完全
c.达到平衡时乙醇的浓度越大 d.化学反应速率越快
(4)根据表中数据分析,150℃时乙醇催化脱水制取的乙醚产量大于(选填“大于”、“小于”、“等于”)125℃时;为了又快又多地得到产品,乙醇制乙醚合适的反应温度区域是150~175℃.
15.由铝屑与盐酸、氢氧化钠溶液反应制取1molAl(OH)3,最少需要消耗HC1和NaOH的物质的量为( )
| A. | 3 mol、3 mol | B. | 1 mol、1 mol | ||
| C. | 0.75 mol、0.75 mol | D. | 0.25 mol、0.25 mol |
19.向盛有硫酸铜水溶液的试管里滴加氨水,首先形成难溶物,继续滴加氨水,难溶物溶解得到深蓝色的透明溶液,下列对此现象的说法不正确的是( )
| A. | 开始滴加氨水时形成的难溶物为Cu(OH)2 | |
| B. | 沉淀溶解后,生成深蓝色的配合离子[Cu(NH3)4]2+配位数为4 | |
| C. | 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 | |
| D. | [Cu(NH3)4]2+中,Cu2+提供空轨道,NH3给出孤电子对 |


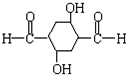 .
.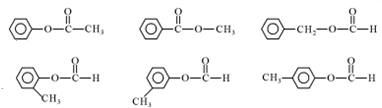 (其中任一种).
(其中任一种).