题目内容
15.下列说法中,正确的是( )| A. | 配制溶液定容时俯视刻度线将使所配溶液浓度偏低 | |
| B. | 18g H2O在标准状况下的体积为22.4L | |
| C. | 在标准状况下,20mLNH3 与60mLO2所含的分子数比为1:3 | |
| D. | 将40g NaOH溶于1L水中,所得溶液的物质的量浓度为1mol/L |
分析 A.配制溶液定容时俯视刻度线,导致溶液体积偏小,依据C=$\frac{n}{V}$进行误差分析;
B.气体摩尔体积使用对象为气体;
C.同温同压下,气体体积之比等于分子数目之比;
D.物质的量浓度中,体积为溶液的体积,非溶剂的体积.
解答 解:A.配制溶液定容时俯视刻度线,导致溶液体积偏小,依据C=$\frac{n}{V}$可知,溶液浓度偏高,故A错误;
B.标况下,水是液体,不能使用气体摩尔体积,故B错误;
C.在常温常压下20mLNH3和60mL氧气所含的分子数目之比为20mL:60mL=1:3,故C正确;
D.将40g NaOH(1mol)溶于1L水中,溶液的体积大于1L,所得溶液的物质的量浓度小于1mol/L,故D错误;
故选:C.
点评 本题考查物质的量有关计算及阿伏伽德罗常数的应用,明确以物质的量为核心的相关计算公式,熟悉气体摩尔体积使用条件和对象是解题关键,注意对物质的量浓度中体积的理解,题目难度不大.

练习册系列答案
 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案
相关题目
6.NA代表阿伏加德罗常数,下列说法中正确的是( )
| A. | 11.2L氧气所含原子数是NA | |
| B. | 80g硝酸铵所含氮原子数是2NA | |
| C. | 1 mol 氦气所含氦原子数是2NA | |
| D. | 1L1mol/L的盐酸溶液中所含氯化氢分子数是NA |
10.下列解释事实的方程式不正确的是( )
| A. | 用浓盐酸检验氨:NH3+HCl═NH4Cl | |
| B. | 切开的金属Na暴露在空气中,光亮表面逐渐变暗4Na+O2═2Na2O | |
| C. | Na2O2在潮湿空气中放置一段时间,变成白色粘稠物2Na2O2+2CO2═2Na2CO3+O2 | |
| D. | 长期盛放石灰水的试剂瓶内壁出现白色固体:Ca(OH)2+CO2═CaCO3↓+H2O |
20.下列物质的分子组成不符合通式CnH2n-6的是( )
| A. |  | B. |  | C. | 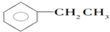 | D. | 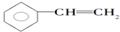 |
4.下列叙述中,正确的是( )
| A. | 原子晶体中只含有共价键 | |
| B. | 分子晶体中只存在分子间作用力,不存在化学键 | |
| C. | 离子晶体中只含有离子键,不含共价键 | |
| D. | 任何晶体中,若含有阳离子也一定含有阴离子 |
5.下列有关物质的表达式不正确的是( )
| A. | 乙烯的结构简式:CH2 CH2 | B. | CS2分子的结构式:S═C═S | ||
| C. | 醛基的结构简式:-CHO | D. | 羟基的电子式:${\;}_{\;}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$H |
 对如图中两极进行必要的连接并填空:
对如图中两极进行必要的连接并填空: