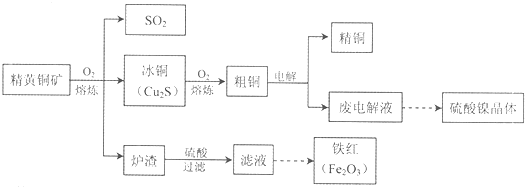
题目内容
13. 某小组以工业氧化铁、草酸、盐酸、异丙醚为原料,合成晶体X[化学式为Fe2(C2O4)3•5H2O],并确定其纯度.
某小组以工业氧化铁、草酸、盐酸、异丙醚为原料,合成晶体X[化学式为Fe2(C2O4)3•5H2O],并确定其纯度.①晶体X的合成,将工业氧化铁溶于盐酸中,然后加入异丙醚萃取、分液,除去水层后,加入草酸溶液后分液,除去醚层,再经过操作A,然后过滤、洗涤、干燥,得到晶体X.
②晶体X纯度的测定:称取ag样品,加入硫酸酸化,用bmol•L-1的KMnO4溶液滴定生成的H2C2O4,达到滴定终点时,共消耗KMnO4溶液cmL.
回答下列问题:
(1)氧化铁能被异丙醚萃取的原因是FeCl3在异丙醚中的溶解度大于其在水中的溶解度.
(2)操作A的名称为蒸发浓缩、冷却结晶,进行操作A时使用的玻璃仪器有酒精灯、玻璃棒、蒸发皿.
(3)晶体X需用冰水洗涤,其目的是除去杂质、减少草酸铁晶体的溶解损耗.
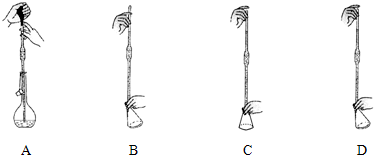
(4)KMnO4溶液应置于如图所示的仪器甲(填“甲”或“乙”)中,滴定过程中发生反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4=2K2SO4+1MnSO4+10CO2↑+8H2O(在方框中填入相应物质的化学计量数),滴定终点的现象是滴入最后一滴溶液,溶液变化为紫色且半分钟不变.
(5)样品中晶体X纯度的表达式为:$\frac{2330bc×1{0}^{-3}}{6a}$×100%.
(6)滴定过程中,若滴定管在滴定前尖嘴部分有气泡,滴定后消失,则滴定结果将偏高(填“偏高”或“偏低”).
分析 (1)萃取是利用溶质在不同溶剂中的溶解度差异分离提取物质的一种方法,能萃取说明FeCl3在异丙醚中的溶解度大于其在水中的溶解度;
(2)草酸铁溶液中得到草酸铁晶体的方法是蒸发浓缩,冷却结晶,过滤洗涤,干燥得到晶体;蒸发过程中是在蒸发皿中进行,需用玻璃棒;
(3)洗涤是除去沉淀表面杂质,冰水是减少沉淀溶解损失;
(4)高锰酸钾溶液能氧化橡胶管,氧化还原反应中失电子的元素化合价升高,得电子的元素化合价降低,化合价降低数目=化合价升高数目=转移的电子数目,高锰酸钾溶液具有强氧化性,酸性溶液中高锰酸钾溶液氧化草酸为二氧化碳,本身被还原为锰离子,结合原子守恒和电荷守恒配平书写;
(5)依据草酸根离子守恒结合化学方程式定量关系计算得到;
(6)滴定过程中,若滴定管在滴定前尖嘴部分有气泡,滴定后消失,则标准溶液体积读取增大,则测出的晶体X纯度会增大.
解答 解:(1)萃取是利用溶质在不同溶剂中的溶解度差异分离提取物质的一种方法,能萃取说明FeCl3在异丙醚中的溶解度大于其在水中的溶解度,
故答案为:FeCl3在异丙醚中的溶解度大于其在水中的溶解度;
(2)草酸铁溶液中得到草酸铁晶体的方法是蒸发浓缩,冷却结晶,过滤洗涤,干燥得到晶体;蒸发过程中是在蒸发皿中进行,且需用玻璃棒搅拌、转移固体,
故答案为:蒸发浓缩;冷却结晶;玻璃棒、蒸发皿;
(3)洗涤是除去沉淀表面杂质,冰水是减少沉淀溶解损失,
故答案为:除去杂质、减少草酸铁晶体的溶解损耗;
(4)高锰酸钾溶液具有强氧化性,能氧化橡胶管,KMnO4标准溶液应置于酸式滴定管,图所示仪器甲中,滴定过程中发生反应:Mn元素由+7价→+2价,一个KMnO4得5个电子;K2C2O4→CO2,C元素由+3价→+4价,一个H2C2O4失去2个电子,反应中KMnO4为氧化剂,H2C2O4为还原剂,最小公倍数为10,所以KMnO4前系数为2,H2C2O4前系数为5,反应为:2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O,离子反应为:2MnO4-+6H++5H2C2O4=10CO2↑+2Mn2++8H2O,滴入最后一滴溶液,溶液变化为紫色且半分钟不变;
故答案为:甲;2、5、3、2、1、10、8;滴入最后一滴溶液,溶液变化为紫色且半分钟不变;
(5)称取ag样品,加硫酸酸化,用b mol•L-1 KMnO4标准溶液滴定生成的H2C2O4.滴定到终点,消耗KMnO4溶液c mL,2MnO4-+6H++5H2C2O4=10CO2↑+2Mn2++8H2O;
2MnO4-~5H2C2O4~$\frac{5}{3}$Fe2(C2O4)3•5H2O
2 $\frac{5}{3}$
c×10-3×bmol $\frac{5}{6}$×bc×10-3mol
样品中晶体X纯度的表达式=$\frac{\frac{5bc}{6}××1{0}^{-3}mol×466g/mol}{ag}$×100%=$\frac{2330bc×1{0}^{-3}}{6a}$×100%,
故答案为:$\frac{2330bc×1{0}^{-3}}{6a}$×100%;
(6)滴定过程中,若滴定管在滴定前尖嘴部分有气泡,滴定后消失,则标准溶液体积读取增大,则测出的晶体X纯度会偏高,故答案为:偏高.
点评 本题考查了物质组成的实验探究和实验过程分析判断,滴定实验的理解应用和计算分析,掌握基础是关键,题目难度中等.

| A. | 此反应是氧化还原反应 | B. | R的分子式为C2H8N2 | ||
| C. | 在反应中N2O4做还原剂 | D. | 生成3mol N2时电子转移数为16mol |
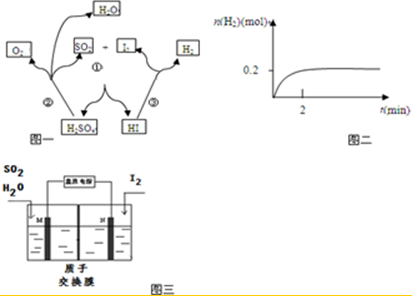
(1)写出反应③的化学方程式2HI?H2+I2,一定温度下,向2L密闭容器中加入2mol HI(g),测得n (H2)随时间的变化如图二所示,则该温度下该反应的平衡常数K=$\frac{1}{64}$.
(2)写出反应①的化学方程式I2+SO2+2H2O=2HI+H2SO4,其中SO2体现的是还原性.
(3)综合①②③三个反应,可看出该化学循环是为了制备某种能源气体,该气体的化学式是H2.
(4)氧缺位铁酸铜(CuFe2O4-δ)是反应②的良好的催化剂.实验室用如下方法制得:
I.在Fe(NO3)3和Cu(NO3)2混合溶液中加入一定量KOH溶液,加热
II. 调节pH并连续搅拌24小时
III.过滤、干燥获得铁酸铜(CuFe2O4)
Ⅳ.在氮气保护下、1 223K时煅烧CuFe2O4,得到CuFe2O3.86
①写出制备得到CuFe2O4的化学方程式2Fe(NO3)3+Cu(NO3)2+8KOH=CuFe2O4+8KNO3+4H2O
②研究发现:
| 温度 | 元素存在形式 |
| 1 200-1 350K | Fe3+部分转变为Fe2+ |
(5)由于该循环中H2SO4 与HI发生副反应造成反应器堵塞,因此有科学家用图三所示原理进行反应.写出阳极的电极反应式SO2+2H2O-2e-=4H++SO42-.请用文字说明在N极能够获得所需物质的原因是M极附近产生的H+通过质子交换膜移动到N极附近,与I2失电子后得到的I-形成HI溶液.
| A. | 铝的摩尔质量为27g | |
| B. | 常温常压下,46g NO2中含有的氧原子数为2NA | |
| C. | 标准状况下,22.4L水中所含有的水分子数NA | |
| D. | 0.1mol•L-1的MgCl2溶液中氯离子物质的量浓度为0.1mol•L-1 |
| A. | H2S | B. | CH4 | C. | H2 | D. | CO |